1、选择题 已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10.在该温度下,向50mL?0.018mol/L的AgNO3溶液中加入50mL?0.02mol/L的盐酸,生成沉淀(混合后溶液的体积变化忽略不计).下列说法正确的是( )
A.AgCl的溶解性为难溶,则该物质不溶于水
B.沉淀生成后,溶液中Ag+的浓度1×10-5?mol/L
C.沉淀生成后,溶液的pH为2
D.沉淀生成后,溶液中NO3-的浓度1.8×10-2?mol/L
参考答案:A.AgCl的溶解性为难溶,则该物质的溶解性很小,绝对不溶于水的物质不存在,故A错误;
B.c(Cl-)=0.01mol/L,c(Ag+)=1×10-100.01=1×10-8mol/L,故B错误;
C.沉淀生成后,c(H+)=0.05L×0.02mol/L0.1L=0.01mol/L,所以pH=2,故C正确;
D.沉淀生成后,溶液中NO3-的浓度为0.05L×0.018mol/L0.1L=9×10-3mol/L,故D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 在常温时的下列溶液中,BaSO4的溶解度最大的是
[? ? ]
A.40?mL?1?mol/L的BaCl2溶液
B.30?mL?2?mol/L的Ba(OH)2溶液
C.10?mL纯水
D.50?mL?0.1?mol/L的H2SO4溶液
参考答案:C
本题解析:
本题难度:一般
3、选择题 已知:在25℃时,?H2O H++OH- ?KW=10-14 ?
H++OH- ?KW=10-14 ?
CH3COOH H++CH3COO- ?Ka=1.8×10-5?
H++CH3COO- ?Ka=1.8×10-5?
KSP[Mg(OH)2]=1.8×10-11?
?KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14?
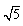 ?=2.2 下列说法正确的是
?=2.2 下列说法正确的是
[? ]
A.醋酸钠水解的平衡常数Kh随温度升高而减小
B.0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m<n?、?a>b ?
C.醋酸钠的水解的平衡常数Kh=?KW?Ka ?
D.在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1?,向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中只有Zn2+?能生成沉淀
参考答案:B
本题解析:
本题难度:一般
4、简答题 用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、Mg2+、Ca2+、Cu2+等)制备氯化锌的一种流程如下:
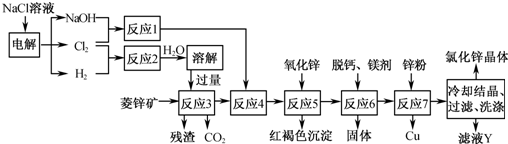
(1)在反应3前要将菱锌矿研磨,其目的是______.
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______.
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为______、______.
(4)锌粉不在反应4之前加入的原因是______.
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有______.
参考答案:(1)依据影响化学反应速率的因素分析判断,增大接触面积会增大反应速率,故答案为:增大反应物接触面积,使反应3反应速率加快;
(2)反应1是氯气与氢氧化钠溶液反应,产物是NaClO、NaClO3和水,反应3中加入了过量盐酸,反应4中将Fe2+氧化为Fe3+,反应的离子方程式为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O,
故答案为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(3)加入氧化锌调节溶液的pH=4.5,同时得到红褐色沉淀Fe(OH)3,同时不引入新的杂质;反应的离子方程式为:ZnO+2H+═Zn2++H2O,Fe3++3H2O?Fe(OH)3↓+3H+,
故答案为:ZnO+2H+═Zn2++H2O;Fe3++3H2O?Fe(OH)3↓+3H+;
(4)因为菱锌矿中含有杂质离子Fe3+,以及加入的盐酸均可以与锌粉反应,这样锌的用量增加,并造成后续反应中所用的次氯酸钠或氯酸钠的用量也增加,
故答案为:Zn和H+以及Fe3+反应,将增加Zn的用量以及后续实验中次氯酸钠(或氯酸钠)的用量;
(5)滤液Y是ZnCl2,用石墨作电极,电解时首先得到H2和Cl2,当ZnCl2浓度较大时还可以得到Zn,故答案为:H2、Cl2、Zn.
本题解析:
本题难度:一般
5、填空题 (1)100℃时纯水Kw=1×10-12?mol2?L-2在该温度下,将1mL?0.001mol?L-1的NaOH溶液的pH为______,若加水稀释至100L,则溶液的pH为______.
(2)室温下,pH=1的稀硫酸a?L与pH=12的苛性钠b?L混合后溶液的pH=2,忽略溶液混合前后体积变化,则a:b=______.
(3)已知25℃时100g水中溶有0.74g的Ca(OH)2即达到饱和,则该条件下Ca(OH)2离子积为Ksp=______.
参考答案:(1)1mL?0.001mol?L-1的NaOH溶液的c(OH-)=c(NaOH)=1×10-3mol/L,所以c(H+)=10-121×10-3mol/L═1×10-9mol/L,所以该溶液的pH=-lg(1×10-9)=9,将1mL?0.001mol?L-1的NaOH溶液,加水稀释至100L,NaOH溶液的c(OH-)≈1×10-6mol/L,所以该溶液的pH=-lg(1×10-6)=6,略呈碱性,接近中性,
故答案为:9; 6;
(2)室温下,pH=1的稀硫酸c(H+)=0.1mol/L,pH=12的苛性钠c(OH-)=c(NaOH)=0.01mol/L,要使得混合后溶液pH=2,则混合后0.1a-0.01ba+b=0.01mol/L,则ab=2:9,
故答案为:2:9;
(3)25℃时100g水中溶有0.74g的Ca(OH)2即达到饱和,则该条件下100克水中溶解0.74克Ca(OH)2,物质的量为0.01mol,此时溶液质量:100.74克,溶液体积:100.74g÷1g/cm3=100.74mL,此时Ca(OH)2物质的量浓度为:C=nV=0.01mol0.10074L=0.099mol/L,所以,此时Ca2+物质的量浓度为:0.099mol/L,OH-物质的量浓度为:0.198mol/L,Ksp=c(Ca2+)×c(OH-)2=0.004 mol3?L-3,
故答案为:0.004 mol3?L-3;
本题解析:
本题难度:一般