1、选择题 已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。下列关于难溶物之间转化的说法中错误的是? ( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于6.34×10-12mol·L-1
参考答案:A
本题解析:Ksp(AgI)小于Ksp(AgCl),AgI比AgCl更难溶于水,AgCl可以转化为AgI,饱和AgCl溶液中Ag+浓度为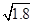 ×10-5 mol·L-1,根据c(Ag+)·c(I-)>Ksp(AgI)时产生AgI沉淀,I-的浓度必须不低于
×10-5 mol·L-1,根据c(Ag+)·c(I-)>Ksp(AgI)时产生AgI沉淀,I-的浓度必须不低于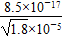 mol·L-1=6.34×10-12 mol·L-1。
mol·L-1=6.34×10-12 mol·L-1。
本题难度:简单
2、选择题 已知25℃时3种难溶电解质的溶度积:AgCl? 1.8 ×10-10;AgI? 1.5×10-16;Mg(OH)2? 1.8 ×10-11。在25℃上述3种难溶电解质各自的饱和溶液中,下列判断正确的是
A.AgCl饱和溶液中c(Ag+)比AgI饱和溶液中c(Ag+)大
B.AgCl饱和溶液中c(Ag+)比Mg(OH)2饱和溶液中c(Mg2+)大
C.将AgCl与AgI的饱和溶液等体积混合,再加入足量浓AgNO3溶液,则发生的反应为:AgCl与AgI沉淀都有,但以AgI沉淀为主。
D.若往AgCl饱和溶液中加入0.1 mol/LKI溶液,有黄色沉淀产生
参考答案:AD
本题解析:考查溶度积常数的应用。难溶电解质达到溶解平衡时,电解质电离出的离子的浓度的幂之积,称为溶度积常数。氯化银的溶度积常数大于碘化银的,所以AgCl饱和溶液中c(Ag+)比AgI饱和溶液中c(Ag+)大,A正确。AgCl饱和溶液中c(Ag+)=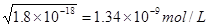 ,Mg(OH)2?饱和溶液中c(Mg2+)=
,Mg(OH)2?饱和溶液中c(Mg2+)=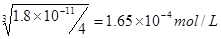 ,所以B不正确。选项C中由于氯离子浓度大于碘离子浓度,所以沉淀以氯化银为主,不正确。根据沉淀转化的实质是向生成更难溶的方向转化,所以选项D也是正确的,答案选AD。
,所以B不正确。选项C中由于氯离子浓度大于碘离子浓度,所以沉淀以氯化银为主,不正确。根据沉淀转化的实质是向生成更难溶的方向转化,所以选项D也是正确的,答案选AD。
本题难度:一般
3、选择题 已知常温下:KSP(AgCl)=1.8×10-10mol2?L-2,KSP(Ag2CrO4)=1.9×10-12mol3?L-3.则下列叙述正确的是( )
A.AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)<KSP(AgBr)
C.将0.001mol?L-1 AgNO3溶液滴入0.001mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液中,先产生Ag2CrO4沉淀
D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
参考答案:A.KSP只于温度有关,与溶液中离子浓度无关.故A错误;
B.沉淀转化为溶解度更小的物质容易发生,向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)>KSP(AgBr).故B错误;
C.在AgCl饱和溶液中,Qc(AgCl)=c(Ag+)?c(Cl-)=0.001mol?L-1×0.001mol?L-1=1×10-6mol2?L-2>1.8×10-10mol2?L-2,在Ag2CrO4饱和溶液中,Qc(Ag2CrO4)=c(Ag+)2?c(CrO42-)=0.001mol?L-1×0.001mol?L-1×0.001mol?L-1=1×10-9mol3?L-3>1.9×10-12mol3?L-3,所以均会产生沉淀,但以AgCl沉淀为主在AgCl饱和溶液中,故C错误;
D.银离子与氨水生成氢氧化二氨合银,使平衡向右移动.故D正确.
故选D.
本题解析:
本题难度:一般
4、选择题 下列说法中正确的是
[? ]
A.汽油燃烧时将全部的化学能转化为热能
B.向饱和AgCl溶液中加入盐酸,Ksp变大
C.若存在简单阴离子R2-,则R一定属于第ⅥA族元素
D.最外层电子数较少的金属元素,一定比最外层电子数比它多的金属元素活泼
参考答案:C
本题解析:
本题难度:简单
5、选择题 已知Zn(OH)2的溶度积常数为1.2×10-17,则Zn(OH)2在水中物质的量浓度为
A.1.4×10-6mol·L-1
B.3.0×10-6mol·L-1
C.1.4×10-9mol·L-1
D.3.0×10-9mol·L-1