1、填空题 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH-
2C+6H2O,则
(1)放电时电极反应方程式:正极______;负极______.
(2)充电时电解质溶液的pH逐渐______(填增大、减小),充电时每生成1molCH3OH转移______?mol电子.
参考答案:(1)放电时,相当于原电池的工作原理,正极是氧气发生得电子的还原反应,即O2+2H2O=4OH-+4e-,负极是甲醇发生失电子的氧化反应,即CH3OH+8OH-=6H2O+CO32-+6e-,故答案为:O2+2H2O=4OH-+4e-;CH3OH+8OH-=6H2O+CO32-+6e-;
(2)充电时,相当于电解池的工作原理,根据反应方程式发现此时生成了氢氧根离子,所以电解质溶液的pH逐渐增大,每生成2molCH3OH转移电子12mol,所以充电时每生成1molCH3OH转移6mol电子,故答案为:增大;6.
本题解析:
本题难度:简单
2、填空题 (8分)水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)在水煤气燃料电池中,通CO、H2的极为电池的 极(选填“正”、“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H<0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H<0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为 。
(4)将标准状况下582.4L合成气[已知:n(CO)∶n(H2)= 4∶9]通入合成塔,一定条件下可发生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反应后,经测定产品中只有甲烷、乙烯和水蒸气(假定CO和H2均无剩余),逸出的气体中乙烯的物质的量为 。
参考答案:(1)负 (1分) (2)abc(1分) (3)N2 + 3H2 2NH3(1分)
2NH3(1分)
(4)3mol(共4分)
本题解析:(1)水煤气燃料电池中,CO、H2发生氧化反应,所以通CO、H2的极为电池的负极。
(2)a、升高温度,反应速率加快,正确;b、加入催化剂,反应速率加快,正确;c、增大压强,反应速率加快,正确,d、降低温度,反应速率减小,错误。
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为:N2 + 3H2 2NH3
2NH3
(4)标准状况下582.4L合成气物质的量为:582.4L÷22.4L/mol=26mol,则n(CO) +n(H2)= =26mol,因为n(CO)∶n(H2)= 4∶9,则n(CO)=26mol×4/(4+9)=8mol,n(H2)=26mol-8mol=18mol,由化学方程式:2CO(g)+ H2(g)→C2H4(g)+2H2O(g)和CO(g)+ 3H2(g) → CH4(g)+ H2O(g),可得:n(CH4)+2n(C2H4)="8mol" ,3n(CH4)+4n(C2H4)=18mol,解得n(C2H4)=3mol。
考点:本题考查原电池原理、影响化学反应速率的因素、化学方程式的书写与计算。
本题难度:一般
3、选择题 下列叙述正确的是
[? ]
A.铜、锌、稀硫酸形成的原电池放电时,溶液中阳离子向铜电极移动
B.充电时,把铅蓄电池的负极接在外电源的正极
C.镀锌铁镀层破损后铁更易被腐蚀
D.碱性氢氧燃料电池工作时,负极反应为:O2+2H2O+4e-=4OH-
参考答案:A
本题解析:
本题难度:一般
4、选择题 银锌电池的充电和放电过程可表示为: 2Ag+Zn(OH)2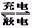 Ag2O+Zn+2H2O,此电池放电时,负极上发生反应的物质是(? )
Ag2O+Zn+2H2O,此电池放电时,负极上发生反应的物质是(? )
A.Ag
B.Zn(OH)2
C.Ag2O
D.Zn
参考答案:D
本题解析:根据原电池工作原理,负极上发生氧化反应.元素化合价会升高,所以在放电过程中被氧化的是Zn,即Zn为负极.
本题难度:一般
5、选择题 氢氧燃料电池已用于航天飞机。以硫酸溶液为电解质溶液,电子经外电路、质子经内电路到达另一电极后发生电极反应,这种电池在使用时的电极反应如下:
2H2 - 4e- = 4H+? O2 + 4e- + 4H+ = 2H2O
下列说法不正确的是
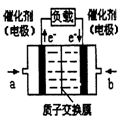
A.右电极为电池正极,b处通入的物质是氧气
B.左电极为电池负极,a处通入的物质是氧气
C.供电时的总反应为:2H2 + O2 = 2H2O
D.H2在负极发生氧化反应
参考答案:B
本题解析:通过电子的流动方向,可推知左电极为电池负极,a处通入的物质是氢气,右电极为电池正极,b处通入的物质是氧气,总反应就是2H2 + O2 = 2H2O,负极发生氧化反应,正极发生还原反应。故错误的是B
本题难度:一般