|
高中化学知识点讲解《常见的化学电源》高频试题预测(2017年最新版)(八)
2017-11-11 01:45:14
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (14分)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)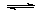 2SO3(g) ΔH= -196.6kJ·mol-1 2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g)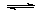 2NO2(g) ΔH= -113.0kJ·mol-1 2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g)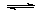 SO3(g)+NO(g)的ΔH= kJ·mol-1。 SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO
| 测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
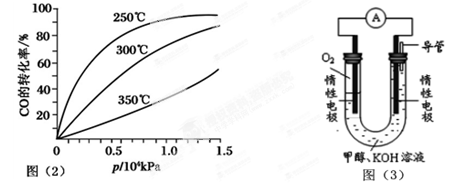
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)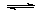 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是: 。
(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
① 该电池工作时,OH-向 极移动(填“正”或“负”)。
② 该电池正极的电极反应式为 。
参考答案:(1)-41.8;BD;1.8;
(2)<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失;
(3)负极; O2+2H2O+4e-=4OH-;
本题解析:
(1)根据盖斯定律,将第二个方程式反写,与第一个方程式相加得:2NO2(g)+2SO2(g)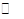 2SO3(g)+2NO(g) 2SO3(g)+2NO(g)
△H="-83.6" kJ?mol-1,则NO2(g)+SO2(g) 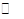 SO3(g)+NO(g) △H="-41.8" kJ?mol-1; SO3(g)+NO(g) △H="-41.8" kJ?mol-1;
A、本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故A不能说明反应已达到平衡状态;
B、随着反应的进行,NO2的浓度减小,颜色变浅,故B可以说明反应已达平衡;
C、SO3和NO都是生成物,比例保持1:1,故C不能作为平衡状态的判断依据;
D、消耗1molSO3为逆向反应,同时生成1mol NO为正向反应,且满足化学计量数之比,说明正逆反应速率相等,故D能作为平衡状态的判断依据。
NO2(g)+SO2(g) 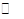 SO3(g)+NO(g) SO3(g)+NO(g)
起始物质的体积 2a a 0 0
转化物质的体积 x x x x
平衡物质的体积 2a-x a-x x x
平衡时NO2(g)与SO2(g)的体积比为5:1,由以上三段式知,(2a-x):(a-x)=5:1,故x=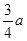 ,故平衡常数K= ,故平衡常数K=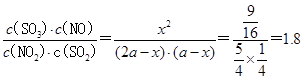 ; ;
(2)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104 kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强,
(3)①根据原电池的工作原理,阴离子向负极移动,所以OH-向负极移动;
②电解质溶液为碱性溶液,所以正极反应为:O2+2H2O+4e-=4OH-;
考点:考查盖斯定律的应用,热化学方程式的书写,化学平衡标志判断,原电池原理应用
点评:本题考查了盖斯定律的应用,热化学方程式的书写,化学平衡标志判断,原电池原理的应用,难度中等。该题将元素化合物知识与能量变化、化学平衡等知识柔和在一起,综合性较强,需要细细分析,各个突破。易错点是(2),要认真分析图像,得出正确结论。
本题难度:困难
2、选择题 关于铅蓄电池的说法正确的是:
A.充电时外接电源的正极与铅蓄电池的正极相联,电极上发生还原反应。
B.放电时,正极上发生的电极反应式为:Pb(s)+SO42-(aq)==PbSO4(s)+2e-
C.放电过程中,正极附近溶液的PH增大。
D.充电时,阳极发生的电极反应式为:PbSO4(s)+2e- ="=" Pb(s)+SO42-(aq)
参考答案:C
本题解析:略
本题难度:简单
3、选择题 全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
 。下列说法正确的是? 。下列说法正确的是?
A.放电时正极反应为: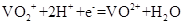
B.充电时阴极反应为: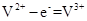
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
参考答案:A
本题解析:
正确答案:A
A、正确;B、不正确,充电时阴极反应为:V3++e― =V2+ ;C、不正确,溶液导电是由阴、阳离子定向移动完成的,电子不能在溶液中定向移动。D、不正确,充电过程中,H+由阳极区向阴极区迁移
本题难度:一般
4、选择题 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。下列说法中不正确的是
A.该电池的负极反应为2SOCl2 + 4e— = S +SO2+4Cl—
B.该电池的负极反应为4Li = 4Li+ + 4e—
C.反应SOCl2 + H2O = SO2↑ + 2HCl↑为非氧化还原反应
D.组装该电池必须在无水的条件下进行
参考答案:A
本题解析:A、负极发生氧化反应,为4Li-4e-=4Li+,错误;B正确;
C、没有化合价的改变,为非氧化还原反应。
D、因为SOCl2与水发生水解反应,故在无水条件下进行。
本题难度:困难
5、选择题 某蓄电池放电、充电时的反应式为:Fe+Ni2O3+3H2O 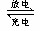 Fe(OH)2+2Ni(OH)2下列推断中正确的是(?) Fe(OH)2+2Ni(OH)2下列推断中正确的是(?)
①放电时,Fe为正极,Ni2O3为负极;②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH-;③充电时,Ni(OH)2为阳极;④蓄电池的电极必须是浸在某碱性溶液中。
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:
D
本题解析:
依据蓄电池放电时是原电池,正极发生还原反应,元素的化合价升高知①错。而充电时是电解池,阳极发生氧化反应,元素的化合价降低,阴极发生还原反应,元素的化合价升高知②③对。又依产物中有Fe(OH)2和Ni(OH)2,故电解质溶液必是碱性溶液。
本题难度:简单
|  CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、