| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《燃烧热》答题技巧(2017年最新版)(四)
盐酸溶液的体积为_________ml。 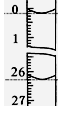 (4)某学生根据3次实验分别记录有关数据如表:
参考答案:(1)浅红色变为无色且半分钟内不恢复 (2)D ? (3) 26.10 本题解析:略 本题难度:一般 3、选择题 下列有关电解质溶液关系正确的是 参考答案:C 本题解析:选项A中盐酸为强酸,醋酸为弱酸,加水稀释时醋酸消耗水的体积大。选项B中油正负电荷守恒得c(Na+)+c(H+)= c(Cl-)+c(CH3COO-)。选项D中H2A酸性强于H2B,B2-离子与氢离子结合的能力强于A2-离子,因此Na2A的碱性弱于Na2B。再根据c(Na+)+c(H+)=c(A2-)+c(OH-) , 本题难度:简单 4、选择题 以甲基橙为指示剂,用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水, 参考答案:C 本题解析:解答本题时要注意两点: 本题难度:一般 5、选择题 下列说法正确的是 参考答案:B 本题解析:A.在铁船闸上装若干锌块以减缓其腐蚀; 本题难度:简单 | ||||||||||||||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《阿伏伽德罗.. | |