1、实验题 (12分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。?
填空:(1)以上步骤有错误的是(填编号)?,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:??;
(4)如下图是某次滴定时的滴定管中的液面,其读数为?mL

(5)根据下列数据:请计算待测盐酸溶液的浓度:?mol·L-1
滴定次数
| 待测液体积(mL)
| 标准烧碱体积(mL)
|
滴定前读数
| 滴定后读数
|
第一次
| 20.00
| 0.40
| 20.40
|
第二次
| 20.00
| 4.00
| 24.00
|
第三次
| 20.00
| 2.00
| 24.10
参考答案:(1)① ,偏大(2)偏小?(3)当溶液恰好由无色变为粉红色且半分钟内不变色?(4)22.60mL?(5)0.2000?mol·L-1
本题解析:(1)滴定管水洗后需再用待装液润洗,否则会使滴定管中溶液浓度偏低,消耗溶液体积偏大,使测定结果偏大。
(2)若滴定前无气泡,滴定后有气泡,则溶液体积偏小,测定结果偏小。
(3)接近终点时,当滴加最后一滴溶液时,溶液变红且30s不褪色,即为终点。
(4)滴定管精确度为0.01mL,每一格表示1mL,图中读数为22.60mL。
(5)第一次和第二次消耗氢氧化钠溶液体积20.00mL,第三次消耗氢氧化钠溶液体积22.10mL,第三次数据应舍去。氢氧化钠溶液体积为20.00mL,氢氧化钠溶液浓度为0.2000mol·L-1,盐酸体积为20.00mL,由n(HCl)=n(NaOH)得盐酸浓度为0.2000?mol·L-1。
点评:计算时引起偶然误差的数据应舍去。
本题难度:一般
2、选择题 下列化学式表示的粒子对H2O的电离平衡不产生影响的是
A.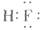
B.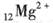
C.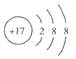
D.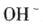
参考答案:C
本题解析:水是一种弱电解质,存在电离平衡,方程式为H2O H++OH-。所以酸或碱能抑制水的电离,而发生水解的某些盐促进水的电离,A、D抑制水的电离,镁离子水解促进水的电离,氯离子既不能促进也不能抑制水的电离,答案选C。 H++OH-。所以酸或碱能抑制水的电离,而发生水解的某些盐促进水的电离,A、D抑制水的电离,镁离子水解促进水的电离,氯离子既不能促进也不能抑制水的电离,答案选C。
本题难度:一般
3、选择题 25 ℃、101 kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是
A.2H2O(l) ===2H2(g)+O2(g);ΔH =+571.6 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g);ΔH =-571.6 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(l);ΔH =+571.6 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l);ΔH =-285.8kJ·mol-1
|
参考答案:A
本题解析:热化学方程式中要主要物质的状态和系数与反应热的对应关系。A、当方程式相反时,反应热的符号也相反,所以该热化学方程式可以表示4克氢气完全燃烧放出热量为142.9×4=571.6kJ,所以正确,选A;B、水的状态不对,所以不选B;C、氢气燃烧时放热的,反应热的符号不对,所以不选C;D、4克氢气反应应该放出142.9×4=571.6kJ的热量,所以不选D。
考点:热化学方程式的书写。
本题难度:一般
4、选择题 形成节约能源和保护生态环境的产业结构是人类与自然和谐发展的重要保证,你认为下列行为中有悖于这一保证的是
A.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
C.在农村推广使用沼气
D.减少资源消耗、增加资源的重复使用和资源的循环再生