1、填空题 为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是______;
(2)当有1 mol I2生成时,有________ mol还原剂被氧化;
(3)当有1 mol氧化剂参与反应时,转移电子的数目为________。
参考答案:(1)KIO3,?I2?(2)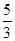 ? (3)5NA
? (3)5NA
本题解析:(1)该反应KIO3+5KI+3H2SO4===3I2+3K2SO4+3H2O中,碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,被氧化。碘酸钾中碘元素的化合价从+5价降低到0价,得到电子,被还原,因此氧化剂是KIO3,氧化产物是I2。
(2)根据方程式可知,每生成3mol单质碘,反应中转移5mol电子,被氧化的还原剂是5mol,所以当有1 mol I2生成时,有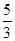 mol还原剂被氧化.
mol还原剂被氧化.
(3)碘酸钾在反应中得到5个电子,所以当有1 mol氧化剂参与反应时,转移电子的数目为5NA。
本题难度:一般
2、选择题 将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0.84mol/L;若要使稀释后溶液中的Cu2+沉淀完全,应加入6.0mol/L的NaOH溶液的体积为:
A.100mL
B.160mL
C.240mL
D.307mL
参考答案:D
本题解析:由题意可知,Cu与CuO的混合物与硫酸反应硫酸有剩余,向稀释后溶液中加入NaOH使Cu2+沉淀完全,硫酸、硫酸铜都与氢氧化钠反应,此时溶液中溶质为Na2SO4,
根据硫酸根守恒可知n(Na2SO4)=n(H2SO4)=0.05L×18.4mol·L-1=0.92mol,
由钠离子守恒可知n(NaOH)=2n(Na2SO4)=0.92mol×2=1.84mol,故需要氢氧化钠溶液的体积=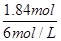 =0.307L=307mL,故选D。
=0.307L=307mL,故选D。
本题难度:一般
3、填空题 实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中氧化剂是_____________,还原剂是__________________。
(2)若反应中有0.20 mol 电子发生转移,生成氯气的体积为?(标准状况),被氧化的HCl的物质的量是?。
参考答案:(1) KMnO4 ,? HCl?;(2)2.24L? , 0.20 mol。
本题解析:在反应2KMnO4+16HCl(浓) ="==" 2KCl+2MnCl2+5Cl2↑+8H2O中,化合价的变化: Mn由KMnO4中的+7价——MnCl2是+2价,化合价降低,得到电子,被还原,发生还原反应,作氧化剂;Cl由HCl的-1价——Cl2的0价,化合价升高,失去电子,被氧化,反应氧化反应,作还原剂。产生5molCl2,转移电子10mol。若转移电子0.20mol,则产生氯气为0.1mol,在标准状况下体积为2.24L。这时被氧化的HCl的物质的量为0.20mol。
本题难度:一般
4、选择题 反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,下列说法正确的是(?)
A.H2CrO4是氧化剂,H2O是氧化产物
B.若3mol H2O2完全反应,则反应中共转移了6NA个电子
C.还原剂与氧化剂的质量比是1:2[M(H2CrO4)=118,M(H2O2)=34]
D.氧化产物和还原产物的物质的量之比为2:3
参考答案:B
本题解析:略
本题难度:一般
5、选择题 锌钡白是一种白色颜料,其主要成分是难溶于水的锌盐和钡盐,它们是?
A.ZnCO3和BaCl2
B.ZnCl2和BaCO3
C.ZnS和BaSO4
D.ZnCO3和Ba(NO3)2
参考答案:C
本题解析:根据内容要求,凭对所学化学知识的记忆能力,直接找出答案。A中BaCl2,B中ZnCl2以及D中Ba(NO3)2均为可溶性盐,而C中的ZnS和BaSO4均为难溶性盐。
本题难度:一般