1、简答题 (1)氯化铝水溶液呈______性,原因是______(用离子方程式表示).把AlCl3溶液蒸干灼烧,最后得到的主要固体产物是______(填化学式).
(2)硫化钠溶于水时发生水解,其水解的离子方程式为______,在配制硫化钠溶液时可以加入少量的______(填化学式)以抑制其水解.
(3)已知:C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
CO(g)+
O2(g)═CO2(g)△H=-283kJ/mol
则1mol?C(s)与O2(g)反应生成CO(g)的热化学方程式为______.
参考答案:(1)氯化铝是强酸弱碱盐水溶液中水解显酸性,水解离子方程式为,Al3++3H2O?Al(OH)3+3H+,加热蒸干水解生成的氯化氢挥发得到水解产物氢氧化铝,灼烧氢氧化铝分解生成氧化铝;
故答案为:酸,Al3++3H2O?Al(OH)3+3H+,Al2O3;
(2)硫化钠溶于水时发生水解,其水解的离子方程式为S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-;在配制硫化钠溶液时可以加入少量的氢氧化钠抑制水解;
故答案为:S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-;NaOH.
(3)①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO(g)+12O2(g)═CO2(g)△H=-283kJ/mol
依据盖斯定律①-②得到C(s)+12O2(g)=CO(g)△H=-110.5kJ/mol;
故答案为:C(s)+12O2(g)=CO(g)△H=-110.5kJ/mol;
本题解析:
本题难度:一般
2、填空题 (1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_____________________________。
(2)根据如下反应式:
A.Na+(g)+Cl-(g)→NaCl(s);△H
B.Na(s)+1/2Cl2(g)→NaCl(s);△H1
C.Na(s)→Na(g);△H2
D.Na(g)-e-→Na+(g);△H3
E.1/2Cl2(g)→Cl(g);△H4
F.Cl(g)+e-→Cl-(g);△H5
写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式__________________________
(3)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
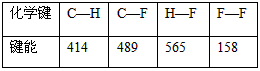
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)==CF4(g)+4HF(g) △H=______________________
参考答案:(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-889.6kJ·mol-1
(2)△H1=△H+△H2+△H3+△H4+△H5
(3)-1928kJ/mol
本题解析:
本题难度:一般
3、选择题 已知热化学方程式C2H2(g)+
O2(g)=2CO2(g)+H2O(g);△H=-1256kJ/mol,下列说法正确的是( )
A.乙炔的燃烧热为1256kJ/mol
B.若转移10mol电子,则消耗2.5mol?O2
C.若生成2mol液态水,则△H=-2512kJ/mol
D.若形成4mol碳氧共用电子对,则放出的热量为2512kJ
参考答案:B
本题解析:
本题难度:一般
4、选择题 已知:H2(g)+F2(g)═2HF(g)△H=-270kJ,下列说法正确的是( ? )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D.2mol氟化氢气体分解成1mol的氢气和1mol的氟气放出270kJ热量
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列图示与对应的叙述相符的是

A.图1表示盐酸滴加到0.1 mol·L-1某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂。
B.图2表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂。
C.图3表示工业上用CO生产甲醇的反应CO(g)+2H2(g) CH3OH(g),该反应的ΔH=-91kJ/mol。
CH3OH(g),该反应的ΔH=-91kJ/mol。
D.图4表示物质的量之比为2∶3的镁和铝分别与过量稀硫酸反应时,产生气体的体积(V)与时间(t)的关系。