1、填空题 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)A和D的氢化物中,沸点较低的是________(填“A”或“D”);A和B的离子中,半径较小的是________(填离子符号)。
(2)C在元素周期表中的位置是______________。
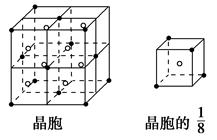
(3)A和E可形成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如上图所示,阳离子(用“.”表示)位于该正方体的顶点或面心,阴离子(用“。”表示)均位于小正方体的中心。该化合物的电子式是___________________________________________。
参考答案:(1)D Na+
(2)第3周期ⅢA族
(3)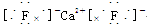
本题解析:本题的突破点主要是“B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水”,可知C的最高价氧化物的水化物为两性氢氧化物,则C是Al元素,则B为Na元素。A、E形成的离子化合物的化学式为EA2,所以E为第ⅡA族的Ca元素,A为第ⅦA族的F元素,则D为Cl元素,结合第(3)问确定。
本题难度:一般
2、选择题 下列正确的叙述有
[? ]
① CO2、NO2、P2O5均为酸性氧化物
② Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③ 碘晶体分散到酒精中、氯化钠晶体分散到酒精中所形成的分散系分别为:溶液、胶体
④ 灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既属于氧化还原反应,又是吸热反应
⑤ 需要通电才可进行的有:电离、电解、电泳、电镀、电化腐蚀
⑥ 氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦ 按照纯净物、混合物、强弱电解质和非电解质顺序排列的是单甘油酯、混甘油酯、苛性钾、次氯酸、氯气
⑧ 金属元素和非金属元素形成的化合物一定是离子化合物
A.3个
B.4个
C.5个
D.6个
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列说法中正确的是
A.共价化合物中一定不含有离子键,离子化合物中可能含有共价键
B.一定条件下1 mol N2与3 mol H2在密闭容器中充分反应可生成2 mol NH3
C.铁质器件附有铜质配件,在接触处易生铁锈
D.共价化合物都是由分子构成的,其熔沸点较低
参考答案:AC
本题解析:略
本题难度:简单
4、填空题 钾、镁、氟、硼等元素在每升海水中的含量都大于1毫克,属于海水中的常量元素。
(1)钾、镁、氟、硼电负性从大到小的排列顺序是__________________________。
(2)镓与硼同主族,写出镓元素原子的价电子排布式(即外围电子排布式):________________。
(3)用价层电子对互斥模型推断BF3和NF3的空间构型分别为________、________。
(4)钾、镁、氟形成的某化合物的晶体结构为K+在立方晶胞的中心,Mg2+在晶胞的8个顶角,F-处于晶胞的棱边中心。由钾、镁、氟形成的该化合物的化学式为________,每个K+与________个F-配位。
参考答案:(1)F>B>Mg>K
(2)4s24p1
(3)平面三角形 三角锥形
(4)KMgF3 12
本题解析:(1)同周期中,随着原子序数的递增,元素电负性增大;同主族中,随着原子序数的递增,元素电负性减小,而且一般情况下,非金属元素的电负性大于金属元素的电负性。
(2)镓为31号元素,位于第四周期,与B同主族,故最外层有3个电子,即价电子排布式为4s24p1。
(3)BF3的中心原子只有3个价电子,与3个F原子提供的3个电子形成3对成键电子,而NF3的中心原子N有5个价电子,与3个F原子提供的3个电子形成3对成键电子,还有1对孤电子对,故前者为平面三角形,后者为三角锥形。
(4)晶胞中的K+为1个,Mg2+为8×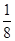 =1个,F-为12×
=1个,F-为12×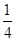 =3个,故钾、镁、氟形成的某化合物的化学式为KMgF3;晶胞12条棱上的12个F-与处于晶胞中心的K+等距离,所以每个K+与12个F-配位。
=3个,故钾、镁、氟形成的某化合物的化学式为KMgF3;晶胞12条棱上的12个F-与处于晶胞中心的K+等距离,所以每个K+与12个F-配位。
本题难度:一般
5、选择题 下列有关化学用语正确的是
[? ]
A.CO2的电子式 
B.Cl-的结构示意图 
C.NH3分子比例模型 
D.质量数为37的氯原子 
参考答案:B
本题解析:
本题难度:简单