1、填空题 探究外界条件对化学反应速率的影响常用到该反应
已知:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O
针对上述反应涉及到的元素或物质及性质回答有关问题:
23.硫元素的化合价由高到低顺序为:______________________________
涉及元素的简单离子半径由小到大顺序为:______________________________;
24.氧原子的最外层电子排布轨道表示式:______________________________;
列举2个能说明氧、硫两种元素非金属性强弱事实:______________________________;
25.预测镁在二氧化硫中燃烧的现象:________________________________________
产物除氧化镁、硫磺外还可能有 生成。
26.下面是某同学是根据该反应实验数据绘制的图表
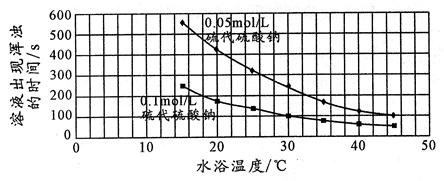
该同学得出的结论是:
_________________________________________________________________________________。
27.将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。
_________________________________________________________________________________。
若继续通入另两种气体如Cl2 和H2S也会产生沉淀,请用化学方程式表示生成沉淀的原理。
_________________________________________________________________________________。
参考答案:23.+6、+4、+2、0 ; H+
本题解析:
本题难度:困难
2、选择题 下列叙述正确的是( )
A.用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷
B.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3
C.BaS04在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同
D.对于可逆反应N2(g)+3H2(g)

2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
参考答案:A、l一溴丙烷中有3种氢原子,2一溴丙烷中有2种氢原子,分子中氢原子种类不同,用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷,故A正确;
B、AlCl3溶液中存在平衡Al3++3H2O?Al(OH)3+3H+,加热HCl挥发,促进水解,蒸干所得固体为氢氧化铝,灼烧氢氧化铝固体产物为Al2O3,NaAl02溶液水解生成氢氧化钠与氢氧化铝,最后又反应生成偏铝酸钠,故B错误;
C、温度一定Ksp(BaS04)不变,同物质的量浓度的硫酸钠和硫酸铝溶液,硫酸铝溶液中硫酸根离子的浓度大,所以硫酸钡在硫酸钠溶液中溶解度大,在硫酸铝溶液溶解度小,故C错误;
D、增大反应浓度,活化分子百分数不变,但单位体积内的反应物分子增多,其中能量较高的活化分子数也同时增多,分子之间碰撞的机会增多,从而使反应速率增大,故D错误.
故选A.
本题解析:
本题难度:简单
3、选择题 设C+CO2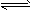 2CO-Q1(吸热反应)反应速率为u1,N2+3H2
2CO-Q1(吸热反应)反应速率为u1,N2+3H2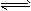 2NH3+Q2(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
2NH3+Q2(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
[? ]
A.同时增大
B.同时减小
C.增大,减小
D.减小,增大
参考答案:A
本题解析:
本题难度:简单
4、填空题 (1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下
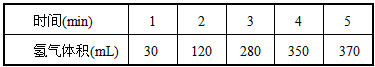
①反应速率最大的时间段(即0~1、l~2、2~3、3~4、4~5 min)为_____________, 原因是_______________________________________
②反应速率最小的时间段为_________,原因是___________________________
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率 A.蒸馏水 B.CuCl2溶液 C.NaCl溶液你认为他上述做法中可行的是__________________(填相应字母);做法中不可行的理由是_______________________________
参考答案:(1)①2-3min;因为该反应是放热反应,此时段温度高;②4-5min;因为此时段c(H+)小
(2)AC;置换出Cu,形成Cu-Zn原电池反应,使反应更快
本题解析:
本题难度:一般
5、选择题 下列说法错误的是( )
A.食物放在冰箱中会减慢食物变质的速率
B.钾的金属性强,所以钾与水的反应比钠的反应剧烈
C.2molSO2与1molO2混合反应后一定能生成2molSO3
D.面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
参考答案:A、温度降低,化学反应速率减慢,所以食物放在冰箱中会减慢食物变质的速率,故A正确;
B、因钾的活泼性强于钠,所以钾与水的反应比钠的反应剧烈,故B正确;
C、因SO2与O2反应生成SO3可逆反应,不可能进行到底,存在一定的限度,故C错误;
D、因面粉厂的空气中含有可燃性的粉,空间有限,遇明火容易引起爆炸,故D正确;
故选:C.
本题解析:
本题难度:一般