1、选择题 经氯气消毒的自来水,若用于配置以下溶液:①NaOH?②AgNO3?③Na2CO3?④FeSO4?
⑤KI?⑥Na2S?⑦Na2SO3会使配置的溶液变质的是?(?)
A.全部
B.②④⑤⑥
C.②⑤
D.④⑥
参考答案:A
本题解析:略
本题难度:一般
2、填空题 漂白粉是日常生活中最常用一种漂白剂和消毒剂。
(1)写出工业上用氯气与熟石灰反应制取漂白粉的化学方程式:____________________________。此反应中氧化剂是___________,1mol氯气完全反应转移电子的物质的量是______________。发生氧化反应的物质是_______________,
(2)漂白粉在酸性条件下可增强漂白效果。写出漂白粉与稀盐酸反应的化学方程式:__________________________________。
(3)漂白粉需要密封避光保存于阴凉处的原因是:_____________________________
参考答案:(1)2Cl2+2Ca(OH)2==Ca(ClO)2+CaCl2+2H2O;Cl2;1mol;Cl2
(2)Ca(ClO)2+2HCl==2HClO+CaCl2
(3)Ca(ClO)2能和空气中CO2、H2O发生反应,以及反应生成的HClO光照或受热会发生分解
本题解析:
本题难度:一般
3、选择题 如图所示,在火棉胶袋(半透膜)内注入淀粉和食盐溶液,用线系紧密封,使细玻管内的液面刚好高出烧杯内蒸馏水的液面,过一段时间后用碘酒和硝酸银溶液分别检验蒸馏水。整个实验过程中,所观察到的现象是
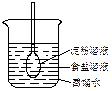
A.细玻管内液面上升
B.细玻管内液面不变
C.蒸馏水遇碘酒变蓝
D.蒸馏水遇硝酸银溶液有白色沉淀生成
参考答案:A、D
本题解析:半透膜袋里的浓度大,因而水进入的比出来的多,细玻璃管液面上升,A正确。食盐中的氯离子通过半透膜进入蒸馏水中,遇硝酸银溶液有白色沉淀生成,而淀粉属于高分子,达到了胶体微粒粒度的范围,不能透过半透膜,因此,加入碘酒不变蓝。
本题难度:简单
4、实验题 某化学小组设计如图实验装置
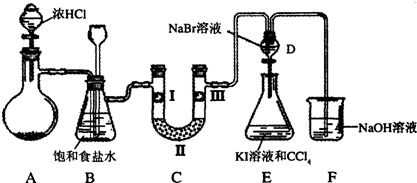
(1)若装置A中的固体药品为KClO3,则写出离子方程式?。
(2)装置B既能除去氯气中的氯化氢,还能检测实验过程中装置C是否发生堵塞。若C中发生堵塞,B中将观察到的现象是?。
(3)装置C的作用是验证氯气是否具有漂白性,l处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是?,?。
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。请简述能说明氯、溴、碘非金属性强弱的实验操作及现象?。(夹持装置略去)制备Cl2并探究氯气的相关性质:
参考答案:(1)ClO3-+5Cl-+6H+=3H2O+3Cl2↑
(2)锥形瓶中液面下降,长颈漏斗中的液面上升;
(3)CaCl2、干燥的有色布条
(4)关闭D中活塞,打开分流漏斗中活塞,若D中溶液的颜色变成红棕色时,关闭A中分流漏斗中的活塞,则说明Cl的非金属强于Br。打开D中活塞,向锥形瓶中滴入少量溶液,振荡E,四氯化碳层呈现柴红色,则非金属性Br强于Cl。
本题解析:本题源于课本中必修1和必修2两上实验的综合,以氯气的制备及性质为线索。
该题的实验目的是,证明Cl2没有漂白性,而次氯酸有漂白性,其的方法是利用有色布条来验证,但必有是有空白对照,由于B中盛放的是溶液,所以Ⅲ处必须入干燥的有色布条,Ⅱ处放中性干燥剂或酸性干燥剂。另一个实验目的就是,验证氯、溴、碘的非金属性,对于实验方法与原理不难理解,难在于怎么回答实验操作与现象,显然是本小题的关键。
本题难度:一般
5、实验题 (1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白。要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是??:
a.干燥的氯气能否使试纸变白? b.水能否使试纸变白?c.盐酸能否使试纸变白
(2)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。如图所示在试管中加入过量的块状碳酸钙.再加入约20ml饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去:过滤,将滤?液滴在蓝色石蕊试纸上发现其漂白性比饱和氯水的更强:已知饱和氨水中存在Cl2+H2O H++C1-+HClO.反应后所得的溶液漂白性增强的原因是?(用化学平衡移动原理解释)。
H++C1-+HClO.反应后所得的溶液漂白性增强的原因是?(用化学平衡移动原理解释)。
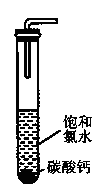
(3)碳酸钙与氯水反应生成的含钙的化合物除氯化钙外,有人提出如下猜想
a.含次氯酸钙? b.含碳酸氢钙? c.含次氯酸钙和碳酸氢钙。
有人认为不可能含有次氯酸钙.他的理由可能是?。
为了证明碳酸氢钙的存在,将滤液分为三份.分别进行以下实验:
①第一份与澄清石灰水混合,立即产生大量白色沉淀:此实验____(填“能”或“不能”)确证溶液中含有碳酸氢钙因为?;
②第二份与稀盐酸混合,立即产生大量无色气体:
③将第三份加热,看到溶液变浑浊且有大量无色气体产生。反应的化学方程式为
④除上述实验外,你能设计的确证碳酸氢钙存在的实验方案是____。
参考答案:(14分,每空2分)
(1)a、c(填abc得1分)
(2)碳酸钙与氢离子反应使其浓度降低,平衡向正反应方向移动,次氯酸浓度增大
(3)次氯酸不能与碳酸钙反应或次氯酸的酸性比碳酸弱
①能,因为Ca(HCO3)2可以与石灰水反应生成白色沉淀
③Ca(HCO3)2 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
④向滤液中滴加少量稀NaOH溶液,若有白色沉淀生成,证明含有碳酸氢钙。
本题解析:
(1)该实验需要做的是对比实验和空白实验,故答案为a、c
(2)根据平衡移动的原理,增加HClO的浓度,漂白性增强,故可以解释。
(3)根据化合物的性质进行相关的探究,可以得到答案。
本题难度:一般