1、选择题 自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生药品变质问题的是 (?)
A.AgNO3
B.FeCl2
C.Na2SO3
D.AlCl3
2、选择题 下列关于氯元素的说法正确的是
A.因 1735Cl、1737Cl为不同的核素,因此具有不同的化学性质
B.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
C.11.2L Cl2含有17NA个质子(NA表示阿伏伽德罗常数)
D.实验室制备Cl2,可用排饱和食盐水集气法收集
3、选择题 下列说法正确的是( )
A.活性炭能使红墨水褪色是因为活性炭具有吸附性
B.干燥的氯气能使干燥的红色布条褪色
C.过氧化钠的漂白是物理变化
D.二氧化硫具有漂白性是因为二氧化硫具有强氧化性
4、简答题 (20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
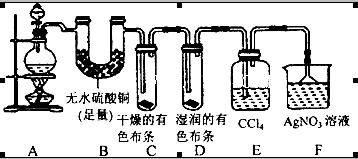
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热;?②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合;?④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热;?⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥? D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条? D.饱和的食盐水
5、填空题 (14分)瑞典化学家舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
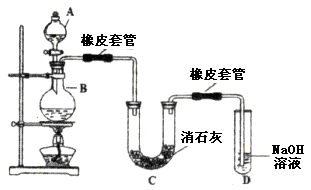
(1)A仪器的名称是__________,所盛试剂是__________,B中发生反应的化学方程式是__________。
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得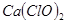 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成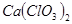 ,为避免此副反应的发生,可采取的措施是______________________________。
,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。为避免此副反应发生,应采取的措施是______________________________。
(4)漂粉精同盐酸作用产生氯气: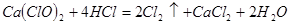 ,该反应中每生成
,该反应中每生成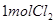 ,转移电子的物质的量为__________
,转移电子的物质的量为__________ ,被氧化的
,被氧化的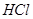 的物质的量为__________
的物质的量为__________ 。有效氯是漂粉精中有效
。有效氯是漂粉精中有效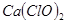 的含量大小的标志。已知:
的含量大小的标志。已知:
有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)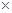 100%,该漂粉精的有效氯为65%,则该漂粉精中
100%,该漂粉精的有效氯为65%,则该漂粉精中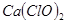 的质量分数为__________(保留一位小数)。
的质量分数为__________(保留一位小数)。