1、选择题 元素X、Y、Z原子序数之和为36,Y、Z在同一周期,X,Z在同一主族,X原子最外层电子数是Y原子最外层电子数的3倍.下列说法正确的是( )
A.同主族元素中X的气态氢化物最稳定
B.Z的最高价氧化物对应的水化物化学式为H3ZO4
C.X与Y可形成共价化合物
D.X与Z所形成的化合物属于酸性氧化物
参考答案:由分析可知X为O元素,Y为Mg元素,Z为S元素.
A、非金属性越强的元素其气态氢化物越稳定,氧族元素中非金属性最强的是O元素,所以氧元素的气态氢化物最稳定,故A正确.
B、Z的最高价氧化物对应的水化物化学式为H2SO4,故B错误.
C、O元素和Mg元素形成的化合物是氧化镁,氧化镁中只含离子键,所以属于离子化合物,故C错误.
D、X和Z形成的化合物SO2、SO3都属于酸性氧化物,故D正确.
故选AD.
本题解析:
本题难度:简单
2、填空题 六种短周期元素aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=
;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻.
(1)E、F形成的化合物甲的电子式为______,该化合物与A2C反应的化学方程式:______.
(2)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式:______.
(3)已知B+BEC3-B2C+E2,请将方程式配平后用双线桥表示电子的转移情况______.
(4)A、E形成的四原子核化合物丙容易液化,其原因是:______.由A、C、E三种元素形成的离子化合物溶液中,离子浓度由大到小顺序为______.
(5)经检测,某固体粉末中仅含有B、C两种元素组成的化合物,请设计实验方案探究该固体粉末的成分______.
参考答案:由a+b=(c+d)2可知,a只能为第一周期元素,则a为H元素,根据a<e<c<b且A、B同主族,可知B不可能为Li,应为Na元素,设C的原子序数为x,则D的原子序数为x+8,则有
x+x+8=2×(1+11),x=8,所以C为O元素,D为S元素,C、E相邻,且e<c,则E为N元素,B、F也相邻,且b<f,则F为Mg元素,则A为氢,B为钠,C为氧,D为硫,E为氮,F为镁,
(1)E、F形成的化合物为Mg3N2,为离子化合物,电子式为
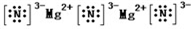
,与水发生反应生成
Mg(OH)2和NH3,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑,
故答案为:
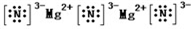
;Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(2)H、O、Na、S对应的化合物有Na2SO4?10H2O、NaHSO4、NaHSO3等,两种化合物的水溶液相互反应的为NaHSO4和NaHSO3,反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(3)反应的方程式为10Na+2NaNO3=6Na2O+N2↑,反应中10Na失去10个电子,电子转移数目为10,可表示为:
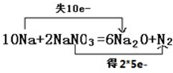
,故答案为:

;
(4)A、E形成的四原子核化合物为NH3,氨分子之间易形成氢键而导致易液化,由A、C、E三种元素形成的离子化合物为
NH4NO3,为强酸弱碱盐,NH4+水解,溶液呈酸性,则溶液中的离子浓度大小为NO3->NH4+>H+>OH-,
故答案为:氨分子之间易形成氢键;NO3->NH4+>H+>OH-;
(5)B、C两种元素组成的化合物为Na2O2、Na2O,Na2O2与水反应生成氧气,有气体生成,而Na2O与水反应没有气体生成,以此可判断是否有Na2O2,根据反应的气体的体积与反应物质量之间的关系可判断固体的成分,具体做法是将粉末加入水中,若无气体生成,则为Na2O,若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物,
故答案为:可能的组成为Na2O2,Na2O或两个都有.将粉末加入水中,若无气体生成,则为Na2O,若有气体生成,可根据一定量该固体粉末产生气体的量确定其全部为Na2O2或是两者的混合物.
本题解析:
本题难度:简单
3、选择题 为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,可以进行下列实验,其中合理、可靠的是
[? ]
A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。结论:SbCl3、SbCl5、 SnCl4都不是离子化合物
C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物
D.测定SbCl3、SbCl5、SnCl4的水溶液的导电性,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列化学用语表达正确的是( )
A.氯化钠的电子式: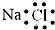
B.NH3的结构式: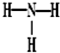
C.S2-的结构示意图: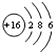
D.乙烯的结构简式:CH2CH2
参考答案:A、氯化钠是钠离子和氯离子通过离子键形成的离子化合物,电子式为: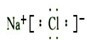 ,故A错误;
,故A错误;
B、氨气是氮原子和氢原子之间通过共价键形成的共价化合物,结构式为: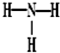 ,故B正确;
,故B正确;
C、硫离子的核外电子数大于核内质子数,应该是18,结构示意图为: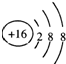 ,故C错误;
,故C错误;
D、乙烯中含有碳碳双键,结构简式中双键不能省略,结构简式为:CH2=CH2,故D错误.
故选:B.
本题解析:
本题难度:简单
5、选择题 下列各组中指定原子序数的元素,能形成AB2型离子化合物的是( ? )?
A.6和8
B.16和18
C.11和15
D.12和9
参考答案:D
本题解析:
本题难度:简单