1、选择题 是某学校实验室从化学试剂商店买回的硫酸试剂标签上的内容。据此,下列说法正确的是

[? ]
A、该硫酸的物质的量浓度为9.2mol/L
B、1molZn与足量的该硫酸反应产生2克H2
C、配制200ml 4.6mol/L的稀硫酸需要取该硫酸50ml
D、该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L
参考答案:C
本题解析:
本题难度:一般
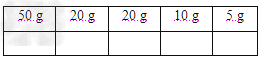
2、实验题 (1)若某药品质量约为32.0?g,用托盘天?平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取?下。
(2)配制500?mL?0.1?mol/L?Na2CO3溶液,下图中操作②中应该填写的数据为________,实验时操作的先后顺序为________(填编号)。?
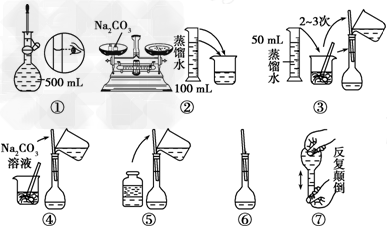
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响。
①用量筒量取液态溶质,读数时,俯视量筒,所配制溶液的浓度________。
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度________。
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度________。
参考答案:(1)?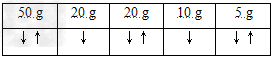
(2)5.3 ;②④③⑥⑤①⑦
(3)①偏低 ;?②偏高 ;③无影响
本题解析:
本题难度:一般
3、选择题 下列各组物质中,其分子数一定相同的是
A.1 g H2和8 g O2
B.1 mol CO和22.4 L CO2
C.标准状况下,1.12 L N2和2.24 L He
D.常温常压下,16 g O2和0.5 mol N2
参考答案:D
本题解析:A、不正确,分子数之比为(1/2):(8/32)=2:1;B、22.4 L CO2的状态末知;C、分子数之比为1:2;D正确,选D。
本题难度:一般
4、选择题 将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是(? )
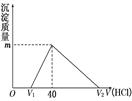
A.原合金质量为0.92 g
B.标准状况下产生氢气896 mL
C.图中m值为1.56 g
D.图中V2为60 mL
参考答案:C
本题解析:反应后得到20 mL pH=14的溶液,所以n(OH-)=0.02mol,所以需要1mol/L的盐酸20mL来中和,因此V1为20mL,继续加盐酸发生AlO2-+H++H2O=Al(OH)3,Al(OH)3+3H+=Al3++3H2O,因此沉淀AlO2-用掉20mL盐酸,溶解Al(OH)3用掉60mL盐酸,所以V2为100mL。所以Al(OH)3为0.02mol,则m为1.56g,原混合物中含有Al为0.54g,当盐酸加100mL时,溶液中的溶质为NaCl和AlCl3,又知n(Cl-)=0.1mol,n(Al3+)=0.02mol,所以n(Na+)=0.04mol。所以原混合物中有Na为0.04mol,质量为0.92g,所以原混合物的质量为0.92g+0.54g=1.46g。反应过程中产生氢气0.05mol,1120mL。所以C项正确,答案选C。
点评:搞清楚图像中每一段发生的变化以及图像中数字的含义。
本题难度:一般
5、计算题 (6分)计算题:
(1)实验室用0.2L 0.5mol/L氢氧化钠溶液来吸收氯气尾气,并利用以下所给的方程式计算: 标准状况下,最多能吸收到多少升氯气?2NaOH+Cl2===NaCl+NaClO+H2O
(2)实验室配制0.5 mol·L-1硫酸溶液500 mL,需要质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为 mL。
参考答案:(1)1.12L (2)13.6
本题解析:(1)NaOH的物质的量为:n(NaOH)=cV=0.5mol/L×0.2L=0.1mol,设可吸收的氯气物质的量为x.则有:
2NaOH+Cl2===NaCl+NaClO+H2O
2 1
0.1mol x 得:x=0.05mol,V=n×22.4L/mol=0.05mol×22.4L/mol=1.12L
(2)质量分数为98%、密度为1.84 g·cm-3的浓硫酸的浓度为:c=1000×1.84 g·cm-3×98%÷98g/mol=18.4mol/L,根据溶液稀释的公式: c浓×V浓=c稀来源:91考试网 91Exam.org×V稀,18.4mol/L×V浓=0.5 mol·L-1×500 mL,V浓=13.6mL
考点:物质的量在化学反应中的应用、溶液稀释的计算。
本题难度:一般