1、填空题 ⑴(7分)高温下,某反应达到平衡,平衡常数K=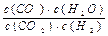 。
。
①该反应化学方程式为?。
②若恒容时,温度升高,H2浓度减小,则该反应焓变为?(填正值或负值)。
③恒温恒压下,若继续向原平衡混合物的容器中通入少量氦气(假设氦气和各物质不反应)后,化学平衡?移动;反应物的转化率?(填增大、减小、或不变);H2的浓度
?(填增大、减小、或不变);
⑵(6分)可逆反应: X+ 3Y(g)? ?2Z(g) +2W(g)达到平衡,混
?2Z(g) +2W(g)达到平衡,混
合物中Y的体积分数随压强(P)与温度T(T2>T1)的变化关系如图示。

①当压强不变时,升高温度,Y的体积分数变?,
平衡向?方向移动,则正反应是?热反应。
②当温度不变时,增大压强,Y的体积分数变 ?,
平衡向?方向移动,则X的状态是?
参考答案: ⑴(7分)①CO2(g)+H2 (g)? CO(g)+H2O (g)
⑴(7分)①CO2(g)+H2 (g)? CO(g)+H2O (g)
②正值;③不移动;不变;减小
⑵(6分)①小 、 正反应?、吸?、 ②大 、?逆反应 、?固体或液体
本题解析:略
本题难度:简单
2、选择题 一定温度下,反应X(g)+3Y(g) 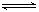 2Z(g)达化学平衡状态的标志是
2Z(g)达化学平衡状态的标志是
A.Z的生成速率与Z的分解速率相等
B.单位时间生成amolX,同时生成3a molY
C.X、Y、Z的浓度相等
D.X、Y、Z的分子数比为1:3:2
参考答案:A
本题解析:化学平衡的本质是正逆反应速率相等,选项A正确,而B只表示了两个逆反应速率,不符合题意。化学反应达到平衡状态时各物质的浓度不再改变,但各物质的量之间没有必然的关系,排除CD。
本题难度:一般
3、选择题 工业上制备纯硅反应的热化学方程式如下: SiCl4(g)+2H2(g)===Si(s)+4HCl(g);ΔH=+Q kJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
[? ]
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达到平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025 Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好反应
参考答案:D
本题解析:
本题难度:简单
4、填空题 (共10分)在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) ?xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
?xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
(1)x=__________
(2)温度降低,平衡向右移动,则正反应是_____(填“放热”或“吸热”)反应。
(3)B的转化率为_________。
(4)能判断该反应达到平衡状态的依据是________(填编号)
A. 混合气体的密度不变
B. 容器中的压强不再变化
C. 生成D的反应速率是生成B的反应速率的2倍
D. 单位时间内生成3molA,同时生成1molB
(5)2min内平均速率v(A)=____________________________________。
参考答案:(1)1?(2)放热?(3)40%?(4)BC?(5)0.3mol/L min
本题解析:略
本题难度:一般
5、填空题 CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g)?△H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为?。
(2)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
 ?温度(K) ?温度(K)
CO2转化率(%)
n(H2)/n(CO2)
| 500
| 600
| 700
| 800
|
1.5
| 45
| 33
| 20
| 12
|
2
| 60
| 43
| 28
| 15
|
3
| 83
| 62
| 37
| 22
|
根据上表中数据分析:
①温度一定时,提高氢碳比[著轰击],CO2的转化率?(填“增大”“减小”
“不变”)。
②该反应的正反应为?(填“吸”或“放”)热反应。
(3)定条件下,将3 molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)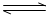 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___?_。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___?_。
a.该条件下此反应的化学平衡常数表达式为
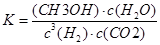
b.H2的平均反应速率为0.3mol/(L.s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
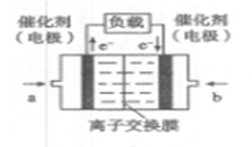
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是?(填“乙醇”或“氧气”),b处电极上发生的电极反应是:?。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其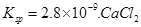 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为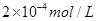 ,则生成沉淀所需CaCl2溶液的最小浓度为?。
,则生成沉淀所需CaCl2溶液的最小浓度为?。
参考答案: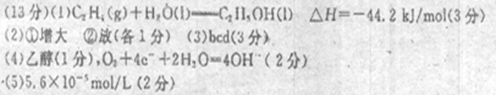
本题解析:
⑴2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g)?△H=十1411.0kJ/mol①
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol②
①-②得
C2H4(g)+H2O(l)=C2H5OH(l)?△H=―44.2kJ/mol
⑵由表中看出,温度一定时,提高氢碳比[著轰击],CO2的转化率①增大;氢碳比一定,提高温度,CO2的转化率,平衡逆向移动,正确反应②放热;
⑶bcd
3H2(g)+CO2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
c始? 1.5? 0.5
c变? 0.6? 0.2? 0.2? 0.2
c平? 0.9? 0.3? 0.2? 0.2
a.正确;
b.不正确, H2的平均反应速率为0.3mol/(L.min)
c.不正确,CO2的转化率为0.2/0.5×100%=40%
d.不正确,混合气体的密度始终不变;
⑷a是电池的负极,原料是乙醇,O2+4e-+2H2O=4OH―
⑸2×2.8×10―9/1×10―4=5.6×10―5mol/L
本题难度:一般