1、选择题 关于可逆反应mA(g)+nB(g)  pC(g)+qD(g)及其图象的说法正确的是(?)
pC(g)+qD(g)及其图象的说法正确的是(?)
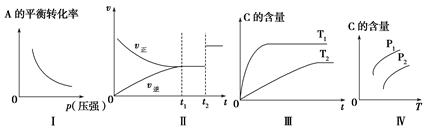
A.若图象为Ⅰ,则m+n>p+q
B.若图象为Ⅱ,则m+n=p+q,t2时刻改变的条件一定是使用催化剂
C.若图象为Ⅲ,则该可逆反应的ΔH<0
D.若图象为Ⅳ,且压强p1>压强p2,则该可逆反应的ΔH>0
参考答案:D
本题解析:若图象为Ⅰ,说明压强越大,A的转化率越低,则m+n<p+q,A错误;若图象为Ⅱ,且m+n=p+q,t2时刻改变的条件可能是增大压强,B错误;若图象为Ⅲ,根据温度越高,反应速率越快,达到平衡时间越短,则T1>T2,温度高时C的含量高,则ΔH>0,C错误;若图象为Ⅳ,且p1>p2,说明温度越高、压强越大,C的含量越高,则ΔH>0,m+n>p+q。
本题难度:一般
2、计算题 (6分)2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(1)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为?。
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是?。
(3)保持同一反应温度,在相同的容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡?移动。(填“正向、不、逆向或无法确定是否)
参考答案:(1)98.3kJ(2)2<a≤3 (3)不(各2分)
本题解析:考查可逆反应的有关计算。
(1)设消耗氧气的物质的量是x,则同时消耗SO2是2x,生成三氧化硫是2x,则3-2x+2-x+2x=(3mol+2mol)×0.9,解得x=0.5mol,所以达到平衡时,放出的热量为0.5mol×196.6kJ/mol=98.3kJ。
(2)根据(1)可知,平衡时三氧化硫的体积分数是2/9mol,所以要满足平衡时SO3的体积分数为2/9,则三氧化硫根据方程式转化为反应物后,SO2和氧气的物质的量分别应该都等于3mol和2mol,所以a的最大值是3mol。根据(1)可知,平衡时SO2的物质的量是2mol,所以要使起始时反应表现为向正反应方向进行,则a必须大于2mol,即a的取值范围是2<a≤3。
(3)设容器容积是1L,则根据(1)可知,平衡时平衡常数是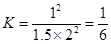 。由于此时
。由于此时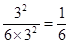 ,所以反应恰好是平衡状态,即平衡不移动。
,所以反应恰好是平衡状态,即平衡不移动。
本题难度:一般
3、选择题 可逆反应N2 + 3H2 2 NH3在一定条件下达到化学反应的限度时,下列判断正确的是
2 NH3在一定条件下达到化学反应的限度时,下列判断正确的是
A.N2完全转化为NH3
B.反应混合物中,NH3的质量分数不再改变
C.N2、H2与NH3的物质的量之比为1∶3∶2
D.消耗1 mol N2的同时消耗2 mol NH3
参考答案:BD
本题解析:略
本题难度:简单
4、选择题
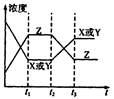

A.增大了X或Y的浓度
B.使用了催化剂
C.增大了体系压强
D.升高了该反应的温度
参考答案:D
本题解析:如果是增大了X或Y的浓度,则在t2时刻X或Y浓度应突然增大,故A不正确,同理可排除C。加催化剂平衡不移动,各组分浓度不变,B也不正确。升高温度平衡逆向移动,使X、Y浓度增大,Z浓度减少,故D正确。
本题难度:一般
5、选择题 某温度下,C和H2O(g)在密闭容器里发生下列反应:C(s)+H2O(g)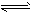 CO(g)+H2(g),CO(g)+H2O(g)
CO(g)+H2(g),CO(g)+H2O(g)
 CO2(g)+H2(g) 当反应达到平衡时,c(H2)=1.9 mol·L-1,c(CO)=0.1 mol·L-1。则下列叙述正确的有
CO2(g)+H2(g) 当反应达到平衡时,c(H2)=1.9 mol·L-1,c(CO)=0.1 mol·L-1。则下列叙述正确的有
[? ]
A.CO在平衡时转化率为10%
B.平衡浓度c(CO2)=c(H2)
C.平衡时气体平均相对分子质量约为23.3
D.其他条件不变时,缩小体积,H2O(g)的转化率随之降低
参考答案:D
本题解析:
本题难度:一般