1、简答题 +2价金属元素M的原子中质子数比中子数少2个,2.1g的单质M与足量的盐酸反应共产生氢气0.05mol.试通过计算确定:
(1)该元素的摩尔质量为______g/mol,
(2)用
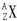
形式表示上题中金属元素M的原子______.
参考答案:(1)设+2价金属元素M的摩尔质量为x,
由2.1g的单质M与足量的盐酸反应共产生氢气0.05mol,
根据电子守恒可知,
2.1gx×2=0.05mol×2×1,
解得x=42g/mol,故答案为:42g/mol;?
(2)设该原子的质子数为y,由+2价金属元素M的原子中质子数比中子数少2个,
则y+(y+2)=42,
解得y=20,为钙元素,元素符号为Ca,
原子可表示为
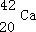
,故答案为:
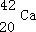
.
本题解析:
本题难度:一般
2、选择题 下列有关化学用语表达正确的是( )
A.Cl 的最外层电子排布式:
的最外层电子排布式: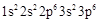
B.聚丙烯的结构简式: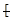 CH2-CH2-CH2
CH2-CH2-CH2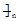
C.CH2Br2只能表示一种物质
D.NH3的电子式: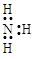
参考答案:C
本题解析:A不正确,氯离子的最外层电子排布式为3s23p6。烯烃发生加聚反应时,碳碳双键上连接的取代基不参与,所以聚丙烯的结构简式为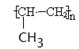 ?,B不正确。由于甲烷是正四面体形结构,所以其二溴代物没有同分异构体,C正确。氨气分子中氮原子还有不参与成键的电子,电子式为
?,B不正确。由于甲烷是正四面体形结构,所以其二溴代物没有同分异构体,C正确。氨气分子中氮原子还有不参与成键的电子,电子式为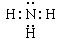 。答案选C。
。答案选C。
本题难度:一般
3、选择题 已知酸性强弱顺序为H2CO2>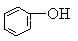 >HCO3—,下列化学方程式正确的是(?)
>HCO3—,下列化学方程式正确的是(?)
A. +H2O+CO2→
+H2O+CO2→ +Na2CO3
+Na2CO3
B. +H2O→
+H2O→ +NaOH
+NaOH
C. +Na2CO3→
+Na2CO3→ +NaHCO3
+NaHCO3
D. +NaHCO3→
+NaHCO3→ +H2CO3
+H2CO3
参考答案:C
本题解析:苯酚的酸性强于碳酸氢钠的,即苯酚能和碳酸钠反应生成苯酚钠和碳酸氢钠,A、D不正确,C正确。苯酚能和氢氧化钠溶液反应,B不正确,答案选C。
点评:该题是中等难度的试题,试题注重基础,侧重对学生能力的培养。该题的关键是利用好“较强酸制备较弱酸”的原理,有助于培养学生的逻辑思维能力,提高学生的学科素养。
本题难度:简单
4、选择题 从元素化合价变化分析,下列变化中必须加入氧化剂才能发生的是(不考虑分解反应)
A.SO2 S
S
B. Na2SO3
Na2SO3 SO2
SO2
C.I —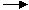 I2
I2
D.KClO3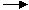 O2
O2
参考答案:C
本题解析:略
本题难度:一般
5、计算题 (8分)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L(各保留二位有效数字)。
(2)待产生的气体全部释放后,向溶液加入VmL amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
参考答案:(1)5.8 5.4 (2)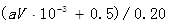 (3)57.8
(3)57.8
本题解析:(1)硝酸的还原产物一般是NO和NO2,即混合气体是NO和NO2,其物质的量是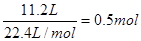 。32.64g铜是
。32.64g铜是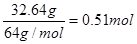 ,共失去电子0.51mol×2=1.02mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.02mol,又因为n(NO)+n(NO2)=0.5mol,所以n(NO)=0.26mol,n(NO2)=0.24mol,其体积分别是0.26mol×22.4L/mol=5.8L,11.2L-5.8L=5.4L。
,共失去电子0.51mol×2=1.02mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.02mol,又因为n(NO)+n(NO2)=0.5mol,所以n(NO)=0.26mol,n(NO2)=0.24mol,其体积分别是0.26mol×22.4L/mol=5.8L,11.2L-5.8L=5.4L。
(2)溶液中的Cu2+恰好全部转化成沉淀后,留在溶液中的就只有硝酸钠,根据钠原子守恒可知硝酸钠是0.001Vamol,再根据氮原子守恒可知,原硝酸的物质的量是(0.001Vamol+0.5mol),所以原硝酸溶液的浓度为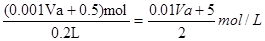 。
。
(3)若使NO和NO2气体全部转化为硝酸钠,则相当于硝酸从铜中得到的电子又被双氧水得到。因为双氧水的还原产物是水,即1molH2O2在反应中得到2mol电子,所以根据得失电子守恒可知需要双氧水的物质的量是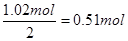 ,其质量为0.51mol×34g/mol=17.34g,因此需要30%的双氧水的质量是17.34g÷30%=57.8g。
,其质量为0.51mol×34g/mol=17.34g,因此需要30%的双氧水的质量是17.34g÷30%=57.8g。
本题难度:困难