1、选择题 下列化学用语表示正确的是
A.含18个中子的氯原子的核素符号: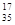 Cl
Cl
B.NaHCO3的电离方程式:NaHCO3=Na++H++CO32—
C.1-丙醇的结构简式:C3H7OH
D.CO(NH2)2的电子式: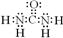
参考答案:D
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,所以A不正确。B不正确,应该是NaHCO3=Na++HCO3—。C不正确,应该是CH3CH2CH2OH。以正确的答案选D。
本题难度:一般
2、填空题 (10分)高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,____ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
①干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
②湿式氧化法的流程如下图:
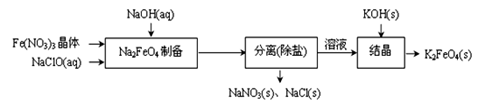
上述流程中制备Na2FeO4的化学方程式是: 。
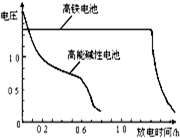
(4)高铁电池是正在研制中的可充电电池,下图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 。
参考答案:(1)其中的铁元素为+6价,易得电子(2分)
(2)高铁酸钾有强氧化性,能杀菌消毒(1分) 产生的Fe(OH)3有吸附性,有絮凝作用(1分)
(3)① 10 (2分) ② 2Fe(NO3)3 + 3NaClO +10NaOH=2Na2FeO4 +3NaCl + 6NaNO3 + 5H2O(2分)
(4)放电时间长 (1分) 工作电压稳定(1分)
本题解析:(1)高铁酸钾中的铁是+6价,处于高价态,易得电子,具有强氧性。
(2)高铁酸钾是具有强氧性,还原产物铁离子水解生成氢氧化铁胶体,具有吸附杂质、絮凝的作用。
(3)①2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是+2价变为+6价,所以每生成2mol Na2FeO4时转移电子10mol;
②Fe(NO3)3被NaClO氧化成Na2FeO4,反应的化学方程式为2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;
(4)高铁电池由图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定等优点,故答案为:放电时间长;工作电压稳定。
考点:考查高铁酸钾的性质、应用以及准备的有关判断与计算
本题难度:困难
3、选择题 下列有关化学用语表示正确的是
A.乙烯的结构简式: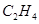 ?
?
B.中子数为20的钾原子:
C.次氯酸的电子式:
D.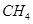 分子的比例模型:
分子的比例模型:
参考答案:D
本题解析:A不正确,应该是CH2=CH2;B不正确,应该是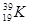 ;C不正确,应该是
;C不正确,应该是 ,所以正确的答案选D。
,所以正确的答案选D。
本题难度:简单
4、选择题 氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2=2AlON+CO(高温)合成,下列有关说法正确的是
A.氮氧化铝中氮的化合价是-3
B.反应中氮气作氧化剂
C.反应中每生成5.7g AlON 同时生成1.12 L CO
D.反应中氧化产物和还原产物的物质的量之比是2:1