1、选择题 已知某元素的最高正化合价为+ 6价,由此得出的结论正确的是
A.该元素在元素周期表中一定处于ⅥA族
B.该元素可能是氧元素
C.该元素可能是硒(Se)元素
D.该元素原子最外层一定是6个电子
参考答案:C
本题解析:最高正价为+6价的元素除了ⅥA族(除氧外),还可能是ⅥB族元素如:铬(Cr)等,其最外层只有一个电子。故A、B、D的说法都是错误的。
本题难度:一般
2、实验题 (18分)
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一 ]探究浓硫酸的氧化性
]探究浓硫酸的氧化性
 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
 (1)该装置设计上存在明显缺陷,其缺陷是?__________
(1)该装置设计上存在明显缺陷,其缺陷是?__________ _______________________?___。
_______________________?___。
 (2)装置甲中反应的化学方程式是___________?___。
(2)装置甲中反应的化学方程式是___________?___。
 (3)装置乙中的试剂是_____________________________________________________。
(3)装置乙中的试剂是_____________________________________________________。
[实验二 ]探究某硫酸亚铁盐固体是否变质
]探究某硫酸亚铁盐固体是否变质
 (4)请你帮助张明同学完成如下实验方案:
(4)请你帮助张明同学完成如下实验方案:
实验操作
| 预期现象和结论
|
 ? ?
| ?
|
[实验三]用KHSO4制取H2O2并测其质量分数
 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
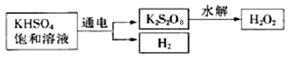

 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
 ①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
 ②用0.1000 mol/L KMnO4溶液滴定;
②用0.1000 mol/L KMnO4溶液滴定;
 ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
 请回答:
请回答:
 (5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________?___。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________?___。
 (7)原H2O2溶液中溶质的质量分数是__________?_____?____。
(7)原H2O2溶液中溶质的质量分数是__________?_____?____。
参考答案:共18分
 (1)装置乙不应有瓶塞? (2分)
(1)装置乙不应有瓶塞? (2分)
 (2)Cu+2H2SO4(浓)
(2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O? (2分)
CuSO4+SO2↑+2H2O? (2分)
 (或C+2H2SO4(浓)
(或C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,其他合理答案也给分)
CO2↑+2SO2↑+2H2O,其他合理答案也给分)
 (3)氢氧化钠溶液(或氢氧化钾溶液等)? (2分)
(3)氢氧化钠溶液(或氢氧化钾溶液等)? (2分)
 (4)往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液;? (2分)
(4)往一支试管中加入少量固体,加水溶解,再滴加几滴KSCN溶液;? (2分)
若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质? (2分)
 (5)2HSO4――2e-=S2O82-+2H+(或2SO42―-2e-=S2O82-)? (3分)
(5)2HSO4――2e-=S2O82-+2H+(或2SO42―-2e-=S2O82-)? (3分)
 (6)催化剂(或加快反应速率)? (2分)
(6)催化剂(或加快反应速率)? (2分)
(7)3.4%? (3分)
本题解析:略
本题难度:一般
3、选择题 已知0.1mol某单质与足量的硫在一定条件下充分反应后,质量增加了1.6g,则该单质可能是(? )
A.钙
B.铜
C.铁
D.铝
参考答案:B
本题解析:增加的质量就是硫的质量,即单质硫是1.6g,得到电子是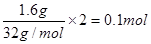 。根据电子的得失守恒可知0.1mol金属就失去0.1mol电子,即金属的化合价是+1价,所以是金属铜,答案选B。
。根据电子的得失守恒可知0.1mol金属就失去0.1mol电子,即金属的化合价是+1价,所以是金属铜,答案选B。
本题难度:简单
4、选择题 24mLH2S在30mLO2中燃烧,在同温同压下,得到SO2的体积为(?)
A.24mL
B.30mL
C.20mL
D.18mL
参考答案:D
本题解析:H2S燃烧的化学方程式:
2H2S+O2(不足) 2S↓+2H2O?①
2S↓+2H2O?①
当O2过量时,继续发生化学反应
S+O2  ?SO2?②
?SO2?②
合并得
2H2S+3O2  ?2SO2+2H2O③
?2SO2+2H2O③
则当V(H2S)∶V(O2)≥2∶1时,只按①式进行。
当V(H2S)∶V(O2)≤2∶3时,只按③式进行。
当2∶3<V(H2S)∶V(O2)<2∶1时,可按①式和②式进行(如按①式和③式进行)。
解法一:2H2S+O2  ?2S↓+2H2O①
?2S↓+2H2O①
2H2S+3O2  ?2SO2+2H2O②
?2SO2+2H2O②
从①式考虑:2H2S?~? O2?~? 2S
24mL? 30mL
可知余O2为:30mL-12mL=18mL
余O2会继续与S反应生成SO2,由此可确定生成SO2的体积:
O2?~? SO2
18mL? 18mL
答案为D。
从②式考虑:2H2S?~? 3O2?~? 2SO2
20mL? 30mL? 20mL
余H2S的体积:24mL-20mL=4mL
因2H2S+SO2 ?2H2O+3S↓
?2H2O+3S↓
4mLH2S将消耗2mLSO2,剩余SO2为20mL-2mL=18mL。
解法二:H2S在O2中燃烧,按H2S与O2的体积比(或物质的量之比)不同,可发生不同的反应。
当V(H2S)∶V(O2)≥2∶1时:只发生2H2S+O2 ?2S↓+2H2O
?2S↓+2H2O
当V(H2S)∶V(O2)≤2∶3时:只发生2H2S+3O2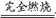 ?2SO2+2H2O
?2SO2+2H2O
现V(H2S)∶V(O2)=24∶30=4∶5,介于2∶1~2∶3之间,所以两个反应均发生。
设不完全燃烧H2S的体积为x,完全燃烧H2S的体积为y,则
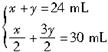 ?解得?
?解得?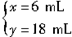
由化学方程式知:生成SO2的体积等于完全燃烧的H2S的体积,即为18mL。
解法三:本题H2S与O2的体积之比为2∶1>V(H2S)∶V(O2)>2∶3,说明两种燃烧方式均存在,可根据题给H2S与O2的体积(或物质的量)之比写出总的反应方程式:
xH2S+yO2  ?xH2O+
?xH2O+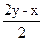 SO2+
SO2+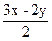 S
S
将x=24mL、y=30mL代入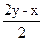 ,
,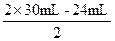 =18mL。
=18mL。
本题难度:简单
5、计算题 含FeS265%的硫铁矿在煅烧时有1.8%的硫损失而混入炉渣,二氧化硫转化为三氧化硫的利用率为99%。由这种硫铁矿制2t98%的硫酸,需硫铁矿多少吨?
参考答案:设需这种硫铁矿的质量为x。
FeS2 2H2SO4
2H2SO4
x? 2×98
x×65%(1-1.8%)×99%? 2t×98%
x=189.9t
本题解析:通过本题的计算进一步掌握物质纯度,转化率、产率的计算关系式,并在多步反应中找出量的相当式进行简捷的计算。
题中65%为硫铁矿的纯度,有1.8%的硫损失也即是1.8%的FeS2损失,二氧化硫的利用率(转化率)也即是FeS2的利用率。设需这种硫铁矿的质量为x。
解法一: FeS2 2H2SO4
2H2SO4
2×98
x×65%(1-1.8%)×99%? 2t×98%? x=189.9t
解法二:S H2SO4
H2SO4
32? 98
64/120x×65%×(1-1.8%)×99%?2t×98%? x=189.9t
确定关系式的关键是根据硫元素守恒。要注意运用某一种化合物中元素的损失率=该化合物的损失率。另外,耗损和利用率、产率和纯度的关系要处理正确。关系式多用于工业生产中的计算题。
本题难度:一般