1、选择题 对下列事实的解释不正确的是
A.在蔗糖中加入浓硫酸后,出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐运输,说明铝与浓硝酸常温下不反应
D.反应CuSO4+H2S=CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶于稀硫酸
参考答案:C
本题解析:A选项,浓硫酸具有脱水性,可使蔗糖脱水生成炭黑,故A正确;B选项,浓硝酸见光分解生成红棕色气体NO2,溶于硝酸,溶液呈黄色,故B正确;C选项浓硝酸与铝发生钝化,在表面生成一层致密的氧化物膜,发生钝化,所以常温下浓硫酸可用铁槽车储运,并不是铝与浓硝酸常温下不反应,故C错误。D选项,根据反应方程式可知,CuS既不溶于水,也不溶于稀硫酸,正确。
本题难度:一般
2、简答题 ?(15分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是?;
(2)Z、W形成的气态氢化物的稳定性_______>_______(写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式_____________________。
(5)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物B,lmolB中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
B.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a、b推知B溶液中含有的离子为__________________;
②B的化学式为_________________。
参考答案:(15分)
(1)H(2分)
(2)H2O? H2S(2分)
(3)3Cu+2NO3-+8H+=3Cu2++2NO↑+4 H2O(3分)
(4)SO2+Cl2+ 2H2O= SO42-+2Cl-+4H+(3分)
(5)①NH4+、Fe2+、SO42-(3分)
②(NH4)2Fe(SO4)2·6 H2O(2分)
本题解析:(1)在周期表中X是原子半径最小的元素,所以X的元素符号是H;
(2)设Z的原子序数是x,则Y、W的原子序数分别是x-1、x+8,所以有x+x+8+x-1+1=32,解得x=8,Y、Z、W分别是N、O、S元素。O的非金属性强于S,所以Z、W形成的气态氢化物的稳定性H2O>H2S;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,则该强酸是硝酸,铜与稀硝酸反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4 H2O;
(4)由H、N、O、S四种元素组成的一种离子化合物A,能与氢氧化钠反应产生气体,说明A中存在铵根离子;A还能与盐酸反应产生气体,且该气体与氯水反应,说明该气体是还原性气体,判断为二氧化硫气体,A为(NH4)2SO3,则二氧化硫与氯水反应生成盐酸和硫酸,离子方程式为SO2+Cl2+ 2H2O= SO42-+2Cl-+4H+
(5)①B与浓碱反应产生刺激性气味的气体,说明B中存在NH4+;与碱反应产生白色沉淀变为灰绿色,最终变为红褐色,说明B中存在Fe2+;加入过量BaCl2溶液产生不溶于盐酸的白色沉淀,说明B中存在SO42-;
②根据B中所含离子的种类,判断由3种离子组成的化学式为(NH4)2Fe(SO4)2,又lmolB中含有6mol结晶水,所以B的化学式中还有6 H2O,所以B的化学式为(NH4)2Fe(SO4)2·6 H2O,与B的相对分子质量是392相符。
本题难度:一般
3、选择题 下列说法中正确的是?( )
A.6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同
B.常温下铁、铜均不溶于浓硫酸, 说明常温下铁、铜与浓硫酸均不反应
C.离子化合物中只含离子键
D.中子数为18的氯原子可表示为18Cl
参考答案:A
本题解析:KHSO4=K++HSO4-。n(KHSO4)="0.05" mol.所以n(HSO4-)="0.05" mol; Na2O2=2Na++O22-.n(Na2O2)=" 0.05" mol,所以所以n(O22-)="0.05" mol;因此阴离子数目相同。正确。B.常温下铁不溶于浓硫酸,是因为Fe在常温下在浓硫酸中会被氧化产生一层致密的氧化物保护膜,阻止了反应的继续减小,而铜不溶于浓硫酸是因为没有达到铜与浓硫酸反应所需要的温度。原因不同。错误。C.离子化合物中一定含离子键,可能含有共价键。如NaOH含有离子键、减小共价键。错误。D.中子数为18的氯原子可表示为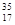 Cl.错误.
Cl.错误.
本题难度:一般
4、实验题 (12分)为研究铁质材料与热浓硫酸的反应,某小组进行了以下探究活动:
【探究一】称取铁钉(碳素钢)12.0 g放入30.0 mL浓硫酸中,加热充分反应后得到溶液X,并收集到气体Y。
(1)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为________(选填序号)
a.KSCN溶液和氯水? b.铁粉和KSCN溶液
c.浓氨水? d.酸性KMnO4溶液
(2)乙同学取672mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O===2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为___________。
【探究二】分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(3)写出产生CO2的化学方程式______________________________________
(4)装置A中试剂的作用是_____________________装置G的作用是??
(5)简述确认气体Y中含有CO2的实验现象___________________________。
(6)如果气体Y中含有H2,预计实验现象应是_________________________。
参考答案:(1)d(1分) (2)66.7%(1分)
(3)C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
(4)除去混合气体中的SO2(2分)、防止空气中的水蒸气进入装置F。(2分)
(5)B中品红溶液不褪色,C中石灰水变浑浊。(2分)
(6)E中黑色固体变红色,F中无水硫酸铜由白色变蓝色。(2分)
本题解析:Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,加入氧化剂再检验。
SO2+Br2+2H2O===2HBr+H2SO4,硫酸钡的质量为4.66 g,n(SO2)=n(BaSO4)=0.02mol
Y中SO2的体积分数为66.7%, C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O(2分)确认气体Y中含有CO2的实验现象要先除去SO2,再检验CO2,SO2用品红溶液,CO2用纯净的石灰水检验。
CO2↑+2SO2↑+2H2O(2分)确认气体Y中含有CO2的实验现象要先除去SO2,再检验CO2,SO2用品红溶液,CO2用纯净的石灰水检验。
本题难度:一般
5、选择题 对于下列事实的解释错误的是( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.浓硫酸常温下与铜不反应,加热时才能发生反应
参考答案:C
本题解析:常温下,铝在浓硝酸中发生钝化,所以浓硝酸可以用铝罐贮存,但钝化属于化学变化。,C不正确,其余都是正确的,所以答案选C。
本题难度:一般