1、选择题 下列有关阿伏加德罗常数(NA)的说法错误的是(? )
A.32克O2所含的原子数目为2NA?
B.0.5molSO2含有的原子数目为1.5NA
C.0.5molSO2含有的分子数目为1.5NA
D.0.5NA个氯气分子(标况下)的体积是11.2L
参考答案:C
本题解析:考查阿伏加德罗常数的应用。32g氧气的物质的量是1mol,所以含有2mol氧原子,选项A正确;SO2是由1个S原子和2个氧原子构成的,共计含有3个原子,所以0.5molSO2含有的原子数目为1.5NA,选项B正确;选项C不正确,0.5molSO2含有的分子数目为0.5NA;根据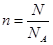 可知,0.5NA个氯气分子的物质的量是0.5mol,所以标准状况下的体积是11.2L,选项D正确,答案选C。
可知,0.5NA个氯气分子的物质的量是0.5mol,所以标准状况下的体积是11.2L,选项D正确,答案选C。
本题难度:一般
2、选择题 Cu、Cu2O和CuO组成的混合物,加入100 mL 0.6mol/LHNO3溶液恰好使混合物溶解,同时收集到224 mLNO气体(标准状况)。下列说法不正确的是
A.产物中硝酸铜的物质的量为0.025 mol
B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol
C.若混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量均为0.005 mol
D.混合物中Cu的物质的量的取值范围为0.005mol<n(Cu)<0.015mol
参考答案:B
本题解析:A、100 mL 0.6mol/LHNO3溶液中硝酸的物质的量=0.1L×0.6mol/L=0.06mol。生成NO的物质的量=0.224L÷22.4L/mol=0.01mol,因此根据氮原子守恒可知,硝酸铜的物质的量=(0.06mol-0.01mol)÷2=0.025mol,A正确;B、若混合物中Cu的物质的量为0.005 mol,则根据铜原子守恒可知,Cu2O、CuO中铜原子的物质的量共计是0.025mol-0.005mol=0.02mol,因此Cu2O、CuO的物质的量一定小于0.020 mol,所以B是错误的;C、若混合物中含0.01moLCu,则铜失去电子的物质的量=0.01mol×2=0.02mol。反应中共转移电子的物质的量=0.01mol×(5-2)=0.03mol,因此根据电子得失守恒可知,氧化亚铜失去电子的物质的量=0.03mol-0.02mol=0.01mol。氧化亚铜在反应中失去2个电子(铜元素的化合价从+1价升高到+2价),所以氧化亚铜的物质的量=0.01mol÷2=0.005mol。则根据铜原子守恒可知,氧化铜的物质的量=0.025mol-0.01mol-0.005mol×2=0.005mol,C正确;D、由于反应中共转移电子的物质的量=0.01mol×(5-2)=0.03mol,因此根据电子得失守恒可知,铜的物质的量一定小于0.03mol÷2=0.015mol。如果混合物中只有铜和氧化亚铜,则设铜和氧化亚铜的物质的量分别是x 和y,则x+2y=0.025mol、2x+2y=0.03mol,解得x=0.005mol、y=0.01mol,因此混合物中铜的物质的量一定大于0.005mol,所以选项D也是正确的,答案选B。
本题难度:一般
3、选择题 实验室需要2.0 mol ·L-1NaOH 溶液90mL ,请回答下列问题: 下列主要操作步骤①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解; ②待冷却至室温后,将溶液转移到100mL 容量瓶中; ③用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3 次,洗涤液转移到容量瓶中; ④加水至液面离容量瓶颈刻度线下12 厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切; ⑤盖好瓶塞,反复上下颠倒,摇匀; 在实验中其他操作均正确,如实验过程中缺少步骤⑤,会使配制出的NaOH 溶液浓度?(? )?A 、偏高? B 、偏低? C 、不变
参考答案:B
本题解析:试题分析:缺少步骤⑤,溶质减少,配制溶液浓度偏低;
本题难度:一般
4、选择题 已知448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为 ( ? )
A.32g/mol
B.64
C.64g
D.64g/mol
参考答案:D
本题解析:448mL某气体在标准状况下的物质的量为0.02mol,则该气体的摩尔质量为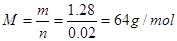
本题难度:一般
5、选择题 工业上将氨气和空气的混合气体通过铂铑合金网发生氨氧化反应,若有标准状况下 VL 氨气完全反应,并转移 n 个电子,则阿伏加德罗常数(NA)可表示为:
A. 11.2n/5V
B. 5V/11.2n
C. 22.4V/5n
D. 22.4n/5v