1、简答题 下表标出的是元素周期表的一部分元素,回答下列问题:
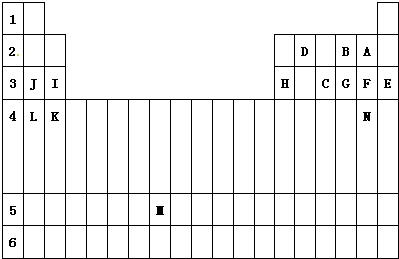
(1)表中用字母标出的14种元素中,化学性质最不活泼的是______(用元素符号表示,下同),非金属性最强的是______,常温下单质为液态的非金属元素是______.J、C、F中,原子半径最小的元素是______;属于过渡元素的是______(该空用字母表示),第六周期的元素共有______种.
(2)F,C气态氢化物中其中以______(填化学式)最不稳定;第三周期对应的碱性最强的最高价氧化物的水化物的化学式是______,该物质含有的化学键类型是______,用该物质做焰色反应实验,火焰呈______色.
(3)N元素在周期表中的位置是______,写出由F单质制取N单质的离子方程式是______.
参考答案:根据元素在周期表中的分布,可以确定D是C,B是O,A是F,J是Na,I是Mg,H是Al,C是P,G是S,F是Cl,E是Ar,L是K,K是Ca,N是Br.
(1)在元素周期表中,稀有气体元素Ar的化学性质最稳定,从左到右元素的非金属性逐渐增强,从下到上,元素的非金属性逐渐增强,所以非金属性最强的是F,液溴是常温下单质为液态非金属元素,同一周期从左到右原子半径逐渐减小,所以Cl的半径是最小的,元素周期表中第4列到第13列均是过渡元素,所以M属于过渡元素,每一周期元素的数目是2n2,
答案为:Ar;F;Br;Cl;M;32;
(2)同周期元素的原子,从左到右氢化物的稳定性逐渐增强,所以稳定性是:HCl>PH3,同周期元素的原子,从左到右最高价氧化物的水化物的碱性逐渐减弱,所以第三周期碱性最强的是氢氧化钠,氢氧化钠中含有钠离子和氢氧根之间的离子键以及氢氧根中氧和氢之间的共价键,属于离子化合物,含有钠元素的物质做焰色反应实验显黄色,
故答案为:PH3;NaOH;离子键和共价键;黄;
(3)元素N为位于周期表中第4周期ⅦA族,氯气可以将溴离子氧化为溴单质,即Cl2+2Br-=2Cl-+Br2,
故答案为:Cl2+2Br-=2Cl-+Br2.
本题解析:
本题难度:一般
2、选择题 下列表达方式错误的是( )
A.H﹕Cl
B.
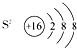
C.818O
D.O=C=O
参考答案:A、氯化氢分子的电子式为
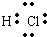
,故A错误;
B、硫离子的结构示意图是:
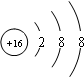
,故B正确;
C、中子数为10的原子的符号为818O,故C正确;
D、CO2分子的结构式:O=C=O,故D正确;
故选A.
本题解析:
本题难度:简单
3、选择题 与氢氧根具有相同质子数和电子数的微粒是
A.F—
B.Cl—
C.NH3
D.NH4+
参考答案:A
本题解析:
本题难度:一般
4、简答题 在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是______;(填元素符号)
(2)金属性最强的元素是______;(填元素符号)
(3)最高价氧化物对应水化物酸性最强的是______,(用化学式回答,下同):它对应的酸酐为______;
(4)最不稳定的气态氢化物是______;
(5)最高价氧化物对应水化物碱性最强的是______;
(6)氧化物中具有两性的是______.
参考答案:(1)同周期元素的原子,从左到右原子半径逐渐减小,所以半径最小的是Cl,故答案为:Cl;
(2)同周期元素的原子,从左到右金属性逐渐减弱,所以金属性最强的是Na,故答案为:Na;
(3)同周期元素的原子,从左到右最高价氧化物对应的水化物的酸性逐渐增强,所以酸性最强的是HClO4,它的酸酐是Cl2O7,故答案为:HClO4;Cl2O7;
(4)同周期元素的原子,从左到右氢化物越来越稳定,最不稳定的是:SiH4,故答案为:SiH4;
(5)同周期元素的原子,从左到右最高价氧化物对应的水化物的碱性逐渐减弱,所以碱性最强的是NaOH,故答案为:NaOH;
(6)具有两是性的氧化物Al2O3,故答案为:Al2O3.
本题解析:
本题难度:一般
5、推断题 具有相同电子层结构的A、B两种离子,可组成AB型离子化合物。A、B的单质在常温时都可与水剧烈反应。试推断: ?
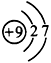
(1)A离子的结构示意图________;B原子的结构示意图___________。 ?
(2)A单质与水反应的离子方程式为__________________。 ?
(3)B单质与水反应的化学方程式为__________________。
参考答案:(1)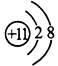 ;
;
(2)2Na+2H2O=2Na++2OH-+H2↑?
(3)2F2+2H2O=4HF+O2
本题解析:
本题难度:一般