|
高考化学知识点总结《物质结构和元素周期律》高频试题预测(2017年最新版)(六)
2017-11-11 02:05:13
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
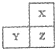
1、选择题 X、Y、Z为短周期主族元素,在周期表位置关系如图,X为非金属元素.下列说法正确的是( )
A.Y和Z的最高价氧化物对应的水化物可能均为强酸
B.X的单质一定能与氧气反应
C.原子半径X>Y>Z
D.Y的单质一定不能与稀硫酸反应
| 
参考答案:A
本题解析:
本题难度:简单
2、推断题 A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示

请回答下列问题:
(1)A在元素周期表中的位置是___________;A与E形成的化合物的电子式是___________。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是_____________________________。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是___________________。
(4)F的盐酸盐水溶液呈酸性,原因是___________________(用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是____________________。
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)
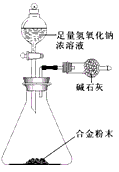
①实验需要测定三个物理量:合金的质量m以及a和b。a是_______;b是________。
②合金中A元素的质量分数是___________(用含m、a、b的式子表示)。
参考答案:(1)第3周期,ⅡA族;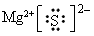
(2)2Fe3+ + Cu == 2Fe2+ + Cu2+
(3)C + H2O CO + H2 CO + H2
(4)Al3+ + 3H2O Al(OH)3 + 3H+;2Al + Fe2O3 Al(OH)3 + 3H+;2Al + Fe2O3 2Fe + Al2O3 2Fe + Al2O3
(5)①反应前装置和药品的总质量;反应后装置和药品的总质量;②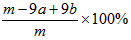
本题解析:
本题难度:困难
3、推断题 短周期元素X、Y、Z可组成化学式为XYZ3的化合物甲、乙、丙、丁。
(1)若甲中X的原子只有一个质子,Y、Z均是第二周期元素,则Y元素的原子结构示意图为______________;Y、Z 中非金属性较强的是_______________(填元素符号)。
(2)若乙中X元素的焰色反应为黄色,Y与X同周期,Y是同周期中原子半径最小的元素,则X与Y形成的化合物含__________________(填“离子”或“共价”)键;乙与浓盐酸反应生成Y单质的化学方程式为_______________________________________。
(3)若丙是一种微溶于水的物质,其Ksp约为1×10-10,且X、Y、Z 三种元素的原子序数之和为26,Y、Z同周期,则丙的电离方程式为__________________________________,其饱和溶液中X离子的浓度约为______________mol/L。
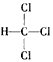
(4)若丁中X、Y、Z处于不同周期,且X原子最外层电子数为其次外层电子数的2倍,Z原子最外层电子数是其电子层数的2倍多1,则丁的结构式为________________________。
参考答案:(1)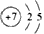 ;O ;O
(2)离子;NaClO3+6HCl(浓)=NaCl+3Cl2↑+3H2O
(3)MgCO3=Mg2++CO32-;1×10-5
(4)
本题解析:
本题难度:一般
4、选择题 几种短周期主族元素的结构与性质信息如下表:
A.X的气态氢化物一定比T的气态氢化物稳定
B.Y单质与T单质不可直接按原子个数1:1化合
C.常温下Z单质能溶于X最高价氧化物对应水化物的浓溶液中
D.一定条件下元素T或X的氢化物可分别与其氧化物反应生成T或X单质
参考答案:D
本题解析:由表格中信息可知:T为O或S;氢化物水溶液呈碱性只有NH3,故X为N;原子半径最大同周期从左到右在减小,从上到下在增大,所以短周期中原子半径最大的是Na;元素最高正价是+3价其最高价氧化物可做耐火材料为Al。若T为O非金属大于N对应气态氢化物更稳定,A错误;N和O可以形成NO,B错误;氨水是弱碱与Al不反应,C错误;答案选D。
本题难度:简单
5、选择题 下列气态氢化物中最稳定的是( )
A.CH4
B.SiH4
C.H2O
D.HI
参考答案:对于C、Si、O、I四种非金属元素来说,C与O处于同一周期,同周期从左到右元素的非金属性增强,即非金属性C<O;
C和Si处于同一主族,同主族从上到下非金属性减弱,即非金属性C>Si.因此,对C、Si、O来说,其非金属性O>C>Si.
对O和Cl来说,可以形成Cl2O7(高氯酸的酸酐),说明O得电子能力比Cl强,即非金属性O>Cl,由于Cl与I同主族,即非金属性Cl>I,故非金属性O>I.
综合上述分析,C、Si、O、I四种非金属元素中O的非金属性最强,即其氢化物在CH4、SiH4、H2O、HCl中最稳定.
故选C.
本题解析:
本题难度:简单
| 