1、推断题 在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的 A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7。其中A、C两元素原子的次外层电子数为8,B、D两元 素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置__________________; D元素基态原子电子排布式为___________________。
(2)E的氢化物在同族元素中沸点最高的原因是_____________________。
(3)A、C两元素第一电离能_______>_______。(填元素符号)
(4)B元素能形成多种配合物。元素之间形成配合物的条件是:一方是能够提供孤电子对的原子或离子,另一方是___________的原子式离子。
(5)A元素可与氢元素形成离子化合物,电子式为____________;这种离子化合物可与水反应,化学方程式为________________________。
2、推断题 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不 在同一周期又不在同一主族。B和C属同一主族,D和E 属同一周期,又知E是周期表中列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图所示。请回答:
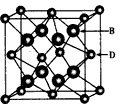
(1)A元素的名称是______________。
(2)B的元素符号是______________,C的元素符号是______________,B 与A形成的化合物比C与A形成的化合物沸点高,其原因是______________________。
(3)E属于元素周期表中第_________周期______族的元素,其元素名称是__________,它 的+2价离子的电子排布式为____________________。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为________________;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是_______________(只要求列出计算式)。
3、选择题 下列有关现在的长式元素周期表的叙述中,正确的是
[? ]
A.从左向右数第7纵行是ⅦA族
B.从左向右数第11纵行是1B族
C.IA族的全部元素都是金属元素
D.ⅦA族的全部元素只能表现出非金属元素的性质
4、选择题 下列元素的原子半径最大的是( )
A.氮
B.磷
C.氧
D.硫
5、选择题 An+、B(n-1)+、C(n+1)+、D(n+1)-都有相同的电子层结构,则原子半径由大到小的顺序是
A.C>D>B>A
B.A>B>C>D
C.B>A>C>D
D.D>B>A>C