1、选择题 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是(?)
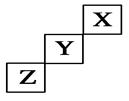
A.X、Y、Z三种元素中,X的非金属性最强
B.Y氢化物的稳定性比Z的氢化物弱
C.Y的最高正化合价为+7价
D.X单质的熔点比Z的低
参考答案:D
本题解析:由题目信息(短周期图示位置关系),可确定X、Y、Z三种元素分别为He、F、S。A项中,非金属性最强的是F;B项中,HF比H2S更稳定;C项中,元素F无正化合价;D项中,因常温常压下He为气体,S为固体,故D正确。
本题难度:一般
2、选择题 下列叙述中,不正确的是
A.N、O、F三种元素的非金属性依次减弱
B.Na、Mg、Al三种元素的原子半径依次减小
C.F、Cl、Br三种原子的核外电子层数依次增多
D.P、S、Cl三种元素的最高价氧化物对应水化物酸性依次增强
参考答案:A
本题解析:同周期自左向右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族自上而下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。非金属性越强,最高价氧化物的水化物的酸性越强,所以选项BCD都是正确的。N、O、F三种元素的非金属性依次增强,选项A不正确,答案选A。
点评:该题是高考中的常见考点和题型,属于基础性试题的考查。主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
3、选择题 X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是
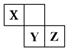
A.化合物XZ3中各原子均满足8电子的稳定结构
B.X、Y、Z三种元素形成的含氧酸都是强酸
C.常温下,Z单质可与Y的氢化物发生置换反应
D.一定条件下,X2与Al反应得到AlX
参考答案:B
本题解析:考查元素周期表的结构。根据元素在周期表的相对位置可以得出,X是第二周期元素,Y、Z是第三周期元素。X通过共用三对电子形成X2分子,说明X的最外层有5个电子,属于第ⅤA,即X是氮元素,则Y、Z是S、Cl。在化合物NCl3中N和Cl的化合价分别是+3价和-1价,均满足8电子稳定结构,A正确。只有这三种元素的最高价氧化物的水化物才是强酸,H2SO3是弱酸,B不正确。氯的非金属性强于硫,所以选项C正确。氮和铝都是活泼的非金属和金属,二者化合可以生成AlN,D正确。答案是B。
本题难度:一般
4、选择题 寻找优良的半导体材料,应在周期表的哪个位置寻找
A.s区
B.p区
C.d 区
D.ds区
参考答案:B
本题解析:半导体材料一般在金属与非金属的分解线上去找,在p区。
本题难度:简单
5、选择题 下列各栏对应关系全部正确的是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A、纯碱的主要成分为Na2CO3,属于盐类;
B、小苏打的主要成分为NaHCO3,属于盐类;
C、磁铁矿的主要成分为Fe3O4,属于金属氧化物;
D、铝土矿的主要成分为Al2O3,属于两性氧化物;
解答:A、因纯碱的主要成分为Na2CO3,属于盐类,故A错误;
B、因小苏打的主要成分为NaHCO3,属于盐类,故B错误;
C、因磁铁矿的主要成分为Fe3O4,属于金属氧化物,故C错误;
D、根据铝土矿的主要成分为Al2O3,属于两性氧化物,故D正确;
故选:D.
点评:本题主要考查了俗称、主要成分化学式以及类别的关系,难度不大,可根据课本知识回答.
本题难度:简单