1、选择题 下列化学实验能达到目的的是
A.用激光笔检验某KI溶液中是否溶有淀粉
B.加入适量溴水后过滤,可除去苯中的少量苯酚
C.向碘水中加入苯或酒精,均可从碘水中萃取碘
D.向AgCl沉淀中滴加少量KI溶液,可说明Ksp(AgCl)<Ksp (AgI)
2、简答题 工业上利用硫酸渣(含Fe2-、Fe3-的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如图:
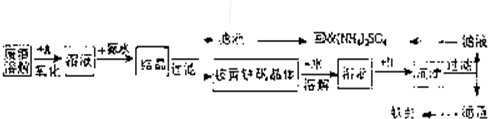
回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸? B.盐酸? C.氢氧化化钠? D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.
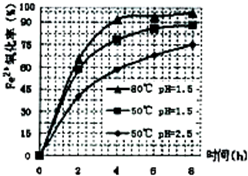
(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:
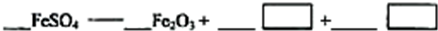
3、选择题 以下实验能获得成功的是
A.用酸性KMnO4溶液鉴别乙烯和丙烯
B.将铁屑、溴水、苯混合制溴苯
C.苯和硝基苯的混合物采用分液的方法分离
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
4、实验题 (11分)已知某工业废水中含有CuCl2、FeCl2、HCl,某化学探究学习小组打算用这种废水制备纯净的FeCl2晶体。为此他们设计了如下的实验方案:

第一步:用上图中的仪器和药品组装 一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。提示:制取CO的原理为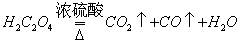 。
。
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是? ??
?? ??
?? ??
?? ?。
?。
(2)正确的操作第一步应是?;最后一步应是熄灭?处的酒精灯。
(3)装置B的作用是?;装置E的作用是?。
(4)第二步:将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
必须进行的操作是?。
(5)第三步:得到纯净的FeCl2晶体。
必须进行的操作是?。
5、实验题 为了探究铁与氯气在一定条件下反应后的固体中铁元素的价态,化学兴趣小组的甲、乙、丙三同学分别进行了如下实验。
(1)甲取少许反应后的固体,加入适量稀硝酸,在所得溶液中滴加KSCN溶液出现血红色,则此时溶液显血红色的离子方程式为_______________________________________。该同学由此得出铁与氯气的反应产物中含有+3价铁的结论。请指出该结论是否合理并说明理由_________________________________________________________。
(2)乙取少许反应后的固体,加入盐酸,溶解、过滤,向滤液中滴加KSCN溶液,溶液呈无色。乙由此得出铁与氯气的反应产物中含有+2价铁的结论。请指出该结论是否合理并说明理由
____________________________________________________________。
(3)丙取11.2g铁粉与氯气反应,将反应后所得固体研碎分成两等份,其中一份用磁铁吸引,吸出的固体质量为1.4g;另一份用水完全溶解后加入足量的硝酸银溶液,所得白色沉淀经洗涤干燥后称重为32.29g。根据以上数据确定反应产物中铁元素的价态是____________(写出计算和推理过程)。