1、填空题 (12分)【化学——物质结构与性质】短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2 np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子。
(1)C元素原子基态时的价电子排布式?,若A元素为非金属元素.A与C形成的化合物中的共价键属于?键(填“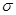 ”或“
”或“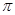 ”)。
”)。
(2)当n=2时.B的最简单气态氢化物的分子构型为?,中心原子的杂化方式为?,BC2属于?分子(填“极性”或“非极性”),当n=3时,B与C形成的晶体属于____?晶体;
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序为?(填元素符号)。
(4)下图为C元素与钛钙元素形成的某晶体结构中的最小重复单元,该晶体中每个钛原子周围与它最近且距离相等的钙离子有?个,该晶体的化学式为?。

参考答案:(1)1s22s22p4,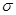 。(2)正四面体,sp3,非极性,原子晶体;(3)N>O>Si>Li。(4)8,CaTiO3。
。(2)正四面体,sp3,非极性,原子晶体;(3)N>O>Si>Li。(4)8,CaTiO3。
本题解析:根据题意知,短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,A元素位于第ⅠA族;B元素的原子价电子排布式为ns2 np2,B元素位于第ⅣA族;C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,则C元素原子基态时的价电子排布式为1s22s22p4,为氧元素;D元素原子的L层的p亚层中有3个未成对电子,则D元素原子基态时的价电子排布式为1s22s22p3,为氮元素;(1)C为氧元素原子基态时的价电子排布式为1s22s22p4,若A元素为非金属元素,则A为氢元素,H与O形成的化合物水和过氧化氢中的共价键均为共价单键,属于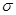 键。(2)当n=2时,B为碳元素,其最简单气态氢化物CH4的分子构型为正四面体,中心原子的杂化方式为sp3,CO2属于非极性分子,当n=3时,B为硅元素,二氧化硅晶体属于原子晶体;(3)若A元素的原子最外层电子排布为2s1,A为锂元素,B元素的原子价电子排布为3s23p2,B为硅元素,A、B、C、D四种元素的第一电离能由大到小的顺序为N>O>Si>Li。(4)根据晶体的晶胞结构可知,该晶体中每个钛原子周围与它最近且距离相等的钙离子有8个,利用切割法计算:1个晶胞中含有Ti:8×1/8=1,O:12×1/4=3,Ca:1,该晶体的化学式为CaTiO3。
键。(2)当n=2时,B为碳元素,其最简单气态氢化物CH4的分子构型为正四面体,中心原子的杂化方式为sp3,CO2属于非极性分子,当n=3时,B为硅元素,二氧化硅晶体属于原子晶体;(3)若A元素的原子最外层电子排布为2s1,A为锂元素,B元素的原子价电子排布为3s23p2,B为硅元素,A、B、C、D四种元素的第一电离能由大到小的顺序为N>O>Si>Li。(4)根据晶体的晶胞结构可知,该晶体中每个钛原子周围与它最近且距离相等的钙离子有8个,利用切割法计算:1个晶胞中含有Ti:8×1/8=1,O:12×1/4=3,Ca:1,该晶体的化学式为CaTiO3。
本题难度:一般
2、选择题 下列叙述中,错误的是(?)
A.原子半径:Na>Mg>O
B.13C和14C属于同位素
C.0族元素是同周期中非金属性最强的元素
D.N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强
参考答案:C
本题解析:同周期元素自左向右原子半径逐渐减小,A正确。.13C和14C的质子数相同,质量数不同,所以这两种核素互称为同位素,B正确。同周期非金属性最强的元素位于第ⅦA,C是错误的。同主族元素自上而下非金属性是减弱的,非金属性越强,相应最高价氧化物对应水化物的酸性就越强,D正确。答案选C。
本题难度:简单
3、填空题 现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B?,C?,指出D在周期表中的位置?。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为?(用化学式表示)。
(3)写出淡黄色固体E的电子式?,其中含有的化学键为?。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式?。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为?。
参考答案:(1)B:钠;? C:镁;?第三周期第ⅦA族; (2)HF?>? HCl?> H2S?;
(3)Na2O2的电子式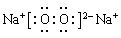 ;?离子键、非极性键(或共价键);
;?离子键、非极性键(或共价键);
(4)4KO2 + 2CO2 =2K2CO3 + 3O2; 1:2
本题解析:A元素形成的—2价阴离子比氦原子的核外电子数多8个,则A是8号元素O;B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;则C为Mg元素;D元素原子的M层上有7个电子。则D为Cl元素。(1)B、C两种元素的元素名称分别是B:钠;C:镁。Cl元素在周期表中的位置是位于第三周期第ⅦA族。(2)Cl、S是同一周期的元素,元素的非金属性Cl>S。元素的非金属性越强,其气态氢化物的稳定性就越强。所以气态氢化物HC>H2S;F、Cl是同一主族的元素。从上到下,元素的原子半 径逐渐增大,元素的非金属性逐渐减弱。所以氢化物的稳定性HF >HCl。所以这些元素的氢化物稳定性由强到弱为HF > HCl > H2S。(3)淡黄色固体Na2O2的电子式为: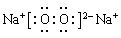 。Na2O2是离子化合物。在Na与O之间以离子键结合,在O、O之间以非极性共价键结合。所以Na2O2中含有的化学键为离子键、非极性键。(4)KO2与CO2发生反应的化学方程式为4KO2 + 2CO2 =2K2CO3 + 3O2;K2O2与CO2反应的方程式为:2K2O2 + 2CO2 =2K2CO3 + O2。若使吸收的CO2与生成的O2体积相同,则n(K2O2):n(KO2)=1:2.
。Na2O2是离子化合物。在Na与O之间以离子键结合,在O、O之间以非极性共价键结合。所以Na2O2中含有的化学键为离子键、非极性键。(4)KO2与CO2发生反应的化学方程式为4KO2 + 2CO2 =2K2CO3 + 3O2;K2O2与CO2反应的方程式为:2K2O2 + 2CO2 =2K2CO3 + O2。若使吸收的CO2与生成的O2体积相同,则n(K2O2):n(KO2)=1:2.
本题难度:一般
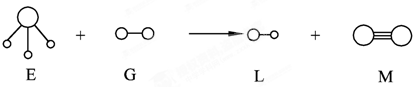
4、选择题 已知分子E和分子G反应,生成两种分子L和M(组成E、G、L、M分子的元素原子序数小于10 “○”代表原子“—”表示化学键),如下图,则下列判断错误的是(未配平)
A.G是最活泼的非金属单质
B.L中的化学键是极性键
C.E能使紫色的石蕊试液变蓝
D.M的化学性质活泼
参考答案:D
本题解析:由图,得:E为三角锥结构,故为氨分子;G、L均为双原子分子;M中两原子间形成三键,故M为氮分子;说明是氨气被氧化成氮气,所以反应为:NH3+F2→HF+N2(未配平);
F原子得电子能力最强,则元素的非金属性最强,A正确;
HF中不同原子间形成极性共价键,故B正确;
氨气溶于水生成一水合氨,能电离出OH-,显碱性,则能使紫色的石蕊试液变蓝,C正确;
氮分子中存在氮、氮三键,作用力较大,故氮分子的化学性质应比较稳定,故D错误;
本题难度:一般
5、选择题 已知某粒子的质子数,则可确定的
A.中子数
B.最外层电子数
C.核电荷数
D.相对原子质量
参考答案:C
本题解析:质子数=核外电子数,所以已知某粒子的质子数,则可确定的是核外电子数,但其余选项不能确定,答案选C。
点评:该题是基础性知识的考查,也是高考中的常见考点。试题基础性强,主要是考查学生对原子组成以及组成微粒之间关系的熟悉了解程度,属于识记性知识的考查,难度不大,记住并能灵活运用即可。
本题难度:简单