1、填空题 碱金属元素原子最外层的电子数都是?个,碱金属元素中金属性最强的是?,原子半径最小的是?。卤素原子最外层的电子数都是?个,;在卤族元素中非金属性最强的是?。
参考答案:1;Cs;Li;7;F
本题解析:碱金属元素包括IA族除氢外的元素:锂、钠、钾、铷、铯、钫(放射性元素,中学阶段不研究)。最外层的电子数=主族序数=1;同主族,由上到下,元素的金属性增强;原子半径增大;
(VIIA族)卤素:F、Cl、Br、I、At(放射性元素,中学阶段不研究)。最外层的电子数=主族序数=7;同主族,由上到下,元素的非金属性减弱;
本题难度:简单
2、选择题 A、B是短周期第ⅦA族元素,元素A的非金属性比B强,下列说法正确的
A.NaA、NaB的晶体都是离子晶体
B.单质A可把B从NaB的溶液中置换出来
C.HA比HB沸点高的原因是1mol HA分子中H-A键断裂时吸收的能量比1mol HB分子中H-B键断裂时需要吸收的能量多
D.常温下,NaA、NaB溶液的pH均大于7
参考答案:A
本题解析:由题意可知A为F元素,B为CL元素;所以
A正确,NaF、NaCL晶体均为离子晶体;B错,将F2通入NaBr溶液中反应的方程式为:
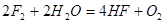 ;C错,HA比HB沸点高的原因是:HF分子间存在氢键;D错,NaF为强碱弱酸盐,溶液显碱性,NaCL为强酸强碱盐,溶液显中性;
;C错,HA比HB沸点高的原因是:HF分子间存在氢键;D错,NaF为强碱弱酸盐,溶液显碱性,NaCL为强酸强碱盐,溶液显中性;
本题难度:一般
3、选择题 人类探测月球发现,月球上有大量3He存在,它可以作为未来核聚变的重要原料之一,以下关于3He的说法正确的是(?)
A.是4He的同素异形体
B.比4He多一个中子
C.是4He的同位素
D.比4He少一个质子
参考答案:C
本题解析:略
本题难度:简单
4、填空题 下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
?主族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0族
|
2
| ?
| ?
| ?
| ①
| ②
| ③
| ?
| ?
|
3
| ④
| ?
| ⑤
| ?
| ?
| ⑥
| ⑦
| ⑧
|
4
| ⑨
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)写出元素符号和名称:
①________,②________,⑧________,⑨________。
(2)写出下列反应的化学方程式:
⑦单质跟④的氢氧化物溶液反应:______________________________
⑤的氧化物跟④的氢氧化物溶液反应:________________________________
⑥的单质在③的单质中燃烧:_____________________________________。
参考答案:(1)①C 碳 ②N 氮 ⑧Ar 氩 ⑨K 钾
(2)Cl2+2NaOH===NaCl+NaClO+H2O
Al2O3+2NaOH===2NaAlO2+H2O S+O2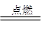 SO2
SO2
本题解析:各元素分别为碳、氮、氧、钠、铝、硫、氯、氩、钾。再结合各元素及其化合物的化学性质即可求得答案
本题难度:一般
5、填空题 (16分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为?。
(2)SO42ˉ的立体构型是?,其中S原子的杂化轨道类型是?。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为?。一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为?,该晶体中,原子之间的作用力是?。
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中心(如下图),该晶体储氢后的化学式应为?;假设在另一条件下,氢原子可进入到由Cu原子与Au原子构成的八面体空隙中心,该晶体储氢后的化学式为?。(提示:查找四面体、八面体时,需假设Cu原子与Au原子等同;每个四面体、八面体内只填充一个氢原子)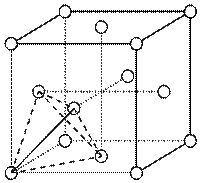
参考答案:(1)? Cu+2H2SO4(浓)="===" CuSO4+SO2↑+2H2O?
(2)?正四面体???sp3?
(3)? 5d106s1?
?3:1???金属键?
(4)? AuCu3H8???AuCu3H4?
本题解析:略
本题难度:一般