1、简答题 有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀.
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是______,一定不含有的物质是______,可能含有的物质是______.(写化学式)
(2)写出各步变化的离子方程式.
①______;
②______;
③______;
④______.
参考答案:依据题干信息和实验过程可知,
①将部分粉末加入水中,溶液呈无色,说明一定不含有CuSO4:振荡,有白色沉淀生成,说明一定含有Ba(NO3)2、Na2CO3生成碳酸钡白色沉淀;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,证明是碳酸钡沉淀;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀,一定有碳酸银沉淀,可能含有氯化银沉淀;
(1)上述分析可知一定含有Ba(NO3)2、Na2CO3,一定不含CuSO4,可能含有NaCl,
故答案为:Ba(NO3)2、Na2CO3;CuSO4;NaCl;
(2)依据各步实验现象可知,
①固体混合得到白色沉淀和无色溶液,一定不含有CuSO4,生成沉淀的是Ba(NO3)2、Na2CO3,生成的碳酸钡沉淀,反应的离子方程式为:Ba2++CO32-=BaCO3↓,
故答案为:Ba2++CO32-=BaCO3↓;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,是碳酸钡沉淀溶于稀硝酸生成二氧化碳气体,反应的离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:Ba2++SO42-=BaSO4↓;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀,依据推断可知一定含有碳酸钠,所以一定有碳酸银沉淀,可能含有氯化银沉淀,反应的离子方程式为:2Ag++CO32-=Ag2CO3↓、Ag++Cl-=AgCl↓,
故答案为:2Ag++CO32-=Ag2CO3↓、Ag++Cl-=AgCl↓.
本题解析:
本题难度:一般
2、实验题 现有一定量含有Na2O杂质的Na2O2试样。请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,约18%的盐酸和水)。
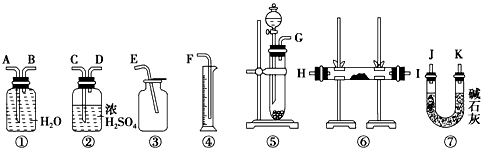
请填写下列空白:
(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式:_______________,______________。
(2)应选用的装置是A____________(只要求写出图中装置的标号)。
(3)所选用装置的连接顺序应是(填各接口的字母,连接胶管省略):____________________。
参考答案:(1)2Na2O2+2H2O===4NaOH+O2↑,Na2O+H2O===2NaOH
(2)①④⑤
(3)G-B-A-F
本题解析:
本题难度:一般
3、简答题 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
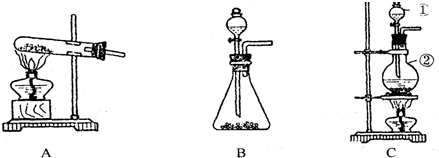
(1)选用A装置可制取的气体有______选用C装置制取的气体有______.
(2)标号①、②的仪器名称依次为______.
(3)写出利用上述有关药品制取氨气的化学方程式:______.
若要制得干燥的氨气,可选用下列干燥剂中的______(填序号).
a.生石灰?b.浓硫酸?c.碱石灰?d.五氧化二磷.
参考答案:(1)A装置中反应物的状态是固体.反应条件是加热,所以可制取氨气;C装置的反应物状态是固体、液体混合态,反应条件是加热,所以可制取氯气.
故答案为:NH3,Cl2.
(2)a是分液漏斗,b是圆底烧瓶.
故答案为:分液漏斗,圆底烧瓶.
(3)氯化铵和氢氧化钙反应生成氨气、水和氯化钙,反应条件是加热.
故答案为:Ca(OH)2+2?NH4Cl?△?.?2?NH3↑+2H2O+CaCl2?
(4)氨气是碱性气体,所以不能用酸作干燥剂,可用碱性物质或中性物质作干燥剂.
故选a?c.
本题解析:
本题难度:一般
4、选择题 下列关于粗盐提纯说法正确的是( )
A.粗盐提纯时每一步都用到玻璃棒,其作用相同
B.粗盐经过溶解、过滤、蒸发、结晶后得到纯净的氯化钠
C.当蒸发到有大量固体析出时,停止加热,利用余热将液体蒸干
D.在粗盐提纯实验中还需要用到烧瓶和石棉网
参考答案:C
本题解析:
本题难度:一般
5、实验题 石灰石的主要成份是碳酸钙,此外还有?SiO2?、?Fe2O3、?Al2O3等杂质。测定石灰石中钙元素的质量百分含量的流程图如下:
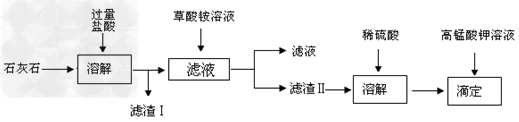
已知:草酸(H2C2O4)是一种二元弱酸。
(1)滤渣Ⅰ的成分是_________,该物质溶于氢氧化钠溶液的化学方程式为__________________________。
(2)请写出生成滤渣Ⅱ(CaC2O4·H2O)的离子方程式____________________。
(3)加入的(NH4)2C2O4?溶液要求是饱和的,其原因是____________。不仅如此,在加入饱和(NH4)2C2O4?溶液后,还需要向溶液中滴加氨水,其原因是_______________?。
(4)将草酸钙沉淀?(CaC2O4·H2O),用硫酸溶解,用a?mol/L的标准高锰酸钾溶液滴定生成的草酸,发生化学反应:H2C2O4?+?MnO4-?+?H+?→?Mn2+?+?CO2?↑+?H2O(未配平),其中还原剂是___________。若开始取用样品的质量为m?g,硫酸溶解后所得草酸溶液的体积为100mL,每次取25.00mL进行滴定,达到滴定终点时所耗KMnO4溶液体积为?b?ml(三次平均值),所得草酸溶液的物质的量的浓度是____________?;石灰石中钙元素的质量百分含量为_________。(相对原子质量:Ca-40)
参考答案:(1)SiO2;SiO2?+?2NaOH?=?Na2SiO3?+?H2O
(2)C2O42-+Ca2++H2O=CaC2O4·H2O↓
(3)保持较大的C2O42-离子浓度,使Ca2+沉淀完全;中和过量的盐酸,使溶液中?C2O42-浓度慢慢增大,可以生成CaC2O4沉淀
(4)H2C2O4;0.1ab?mol/L;0.4ab/m×100%
本题解析:
本题难度:一般