1、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(?)
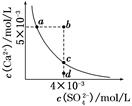
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
参考答案:C
本题解析:A项只有在单一CaSO4溶液中c(Ca2+)、c(SO42-)才相等,A项错误;B项b点Qc>Ksp,故有沉淀生成,开始c(Ca2+)、c(SO42-)不相等而反应消耗的Ca2+、SO42-相等,因此平衡后的两种离子也不会都等于3×10-3 mol/L,B项错误;在平衡线上的Ksp均相等,C项正确;D项d点通过蒸发后各离子浓度都增大,不可能保持SO42-浓度不变而到达c点,D项错误。
本题难度:一般
2、选择题 把熟石灰放入蒸馏水中,一段时间后达到平衡,Ca(OH)2(s)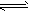 Ca2+(aq)+2OH-(aq),下列说法正确的是
Ca2+(aq)+2OH-(aq),下列说法正确的是
[? ]
A.给溶液加热,溶液的pH升高?
B.恒温下向溶液中加入CaO,溶液的pH升高
C.向溶液中加入Na2CO3溶液,Ca(OH)2固体其中质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量增加
参考答案:A
本题解析:
本题难度:一般
3、推断题 甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,已知:
(1)A和B都极易溶于水,用两根玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白烟;
(2)各物质之间存在如下图所示的转化关系
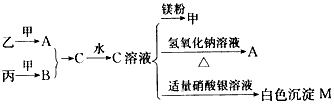
请回答下列问题:
(1)C溶液显_______性(填“酸”“碱”或“中”),若A溶液的物质的量浓度是B溶液的物质的量浓度的2倍,且等体积混合后溶液中各离子浓度由大到小的顺序为__________________(用离子符号表示)。
(2)一定条件下,乙气体与甲气体充分反应生成6.8 g A气体,可放出18. 44 kJ 热量,则该反应的热化学方程式为__________________。
(3)在一定温度下,向容积不变(容积为10 L)的密闭容器中加入2 mol乙气体、 8mol甲气体及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,用乙气体表示的反应速率为
________,反应达平衡状态时甲气体的转化率为_______,若想提高A的产率,根据化学平衡移动原理,请提出合理的建议:__________________(任意写一条);在上述平衡中,若再加入2 mol A气体、2 mol乙气体,则此时化学平衡将____(填“向正方向”“向逆方向”或 “不”)移动。
(4)常温下,向含白色沉淀M的浊液中加入氯化钠固体,M的溶解度将_________ (填“增大”“减小”或“不变”),Ksp(M)将________(填“增大”“减小”或“不变”)。
参考答案:(1)酸;c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(2)N2(g)+3H2(g) 2NH3(g) △H=-92.2 kJ/mol
2NH3(g) △H=-92.2 kJ/mol
(3)0. 01 mol/(L·min);37. 5%;增大氢气浓度或增大氮气浓度或增大反应物的浓度或及时移出氨气或增大压强或降温(其他合理答案均可);向逆方向?
(4)减小;不变
本题解析:
本题难度:一般
4、填空题 阅读下表中短周期主族元素的相关信息。 请回答

(1)在一定条件下,B2与C的单质在海水中可形成原电池,为新型海水航标灯提供能源。写出该原电池正极的电极反应式_____________
(2)用惰性电极电解化合物AD的水溶液,该反应的化学方程式为:_________;其中,阴极产物是__________
(3)常温下,0.1 mol·L-1 X溶液的pH_________7(填“>”“=”或“<”),原因是 _____________(用离子方程式说明)。
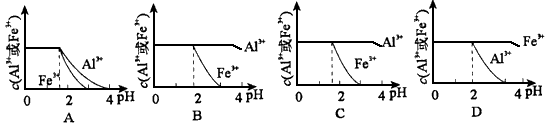
(4)已知Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10 -38。现向pH=0,浓度均为0.04 mol·L-1的Al3+ 、Fe3+溶液中加入A的最高价氧化物对应水化物的溶液,以调节pH(设溶液体积不变),该过程中Al3+、Fe3+的浓度与pH关系正确的是______________(填字母代号)。
参考答案:(1)O2+4e-+2H2O=4OH-
(2) 2NaCl+ 2H2O=2NaOH+Cl2↑+H2↑ ;H2和NaOH
(3)> ;ClO-+H2O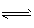 HClO+OH-
HClO+OH-
(4) B
本题解析:
本题难度:一般
5、填空题 (10分)将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。
它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
参考答案:(1)取最后一次洗涤液少许,滴加硝酸酸化的硝酸银溶液,若不产生沉淀,则已经洗涤干净;
(2)8.0×10-4;
(3)5.550g样品中含有n(Mg2+)=n(Mg(OH)2)="(0.580g÷58" g/mol)×2=0.0200mol;
n(MgCl2)= 0.0200mol;n(Cl-)=" n(AgCl)=(4.305g÷143." 5g/mol)×2=0.0600mol;
n(KCl)=0.0600mol-2×0.0200mol=0.0200mol;
n(H2O)= (5.550g-0.0200mol×95g/mol-0.0200mol×74.5g/mol)÷18g/mol=0.120mol.
样品中n(KCl):n(MgCl2):n(H2O)=1:1: 6。所以光卤石的化学式是KCl·MgCl2·6H2O.
本题解析:(1)将向含光卤石(xKCl·yMgCl2·zH2O)的水溶液中加入过量的NaOH溶液,会发生离子反应:Mg2++2OH-=Mg(OH)2↓,而K+、Na+、Cl-则留在滤液中。在步骤②中若要检验白色固体已洗净,只要证明在滤液中无Cl-即可,方法是取最后一次洗涤液少许,滴加硝酸酸化的硝酸银溶液,若不产生沉淀,则已经洗涤干净;
(2)在某温度下Mg(OH)2的Ksp = 6.4×10-12,即c(Mg2+)·c2(OH-)≥6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1 可视为沉淀完全,则应保持溶液的OH-的浓度c2(OH-)≥6.4×10-12÷1.0×10-5 mol·L=6.4×10-7mol/L; c(OH-)≥8×10-4mol/L;
(3) 5.550g样品中含有n(Mg2+)=n(Mg(OH)2)="(0.580g÷58" g/mol)×2=0.0200mol;
n(MgCl2)= 0.0200mol;n(Cl-)=" n(AgCl)=(4.305g÷143." 5g/mol)×2=0.0600mol;
n(KCl)=0.0600mol-2×0.0200mol=0.0200mol;
n(H2O)= (5.550g-0.0200mol×95g/mol-0.0200mol×74.5g/mol)÷18g/mol=0.120mol.
样品中n(KCl):n(MgCl2):n(H2O)=1:1: 6。所以光卤石的化学式是KCl·MgCl2·6H2O.
考点:考查沉淀的洗涤、溶度积常数的应用、守恒等知识。
本题难度:困难