1、选择题 用锌粒和盐酸制氢气时,加入少量下列试剂,可使生成氢气的速率加快的是
[? ]
A.硫酸铜晶体
B.水
C.氯化钡晶体
D.醋酸钾晶体
2、选择题 已知反应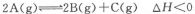 ,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为
,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为
A.减小容器容积 B.增大容器容积
C.减小B的浓度 D.降温
3、填空题 “硫?碘”循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI;?
Ⅱ.2HI H2+I2;?
H2+I2;?
Ⅲ.?2H2SO4 2SO2+O2+2H2O
2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________(单选)。
a.反应Ⅲ是在常温下进行?b.反应Ⅰ中SO2氧化性比I2强
c.循环过程中需补充H2O?d.循环过程产生1?mol?O2的同时产生1?mol?H2
(2)一定温度下,向1?L密闭容器中加入1?mol?HI(g),发生反应Ⅱ, H2物质的量随时间的变化如图所示。0~2?min内的平均反应速率 v(HI)=________。该温度下,Ⅱ的逆反应?H2(g)+I2(g) 2HI(g) 的平衡常数K=________。
2HI(g) 的平衡常数K=________。
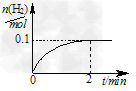
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右” 或“不”),若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3?b.CuSO4?c.Na2SO4?d.NaHCO3
(4)以H2为燃料可制作氢氧燃料电池。已知2H2(g)+O2(g)===2H2O(l) ΔH=-572?kJ/mol 某氢氧燃料电池释放228.8?kJ电能时,生成1?mol液态水,该电池的能量转化率为________。
4、填空题 (1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应
蔗糖水解:
CH3CH(OH)CH3的催化氧化:
(2)(4分).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI Ⅱ.2HI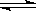 H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。0-2 min内的平均反应速率υ(HI)=
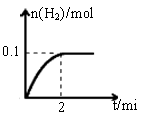
(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是 (填序号)
a.加入浓硝酸 b.加入少量CuSO4固体 c.用粗锌代替纯锌
d.加热 e.把锌粒弄成锌粉 f.用98.3%浓硫酸
5、选择题 已知N2O4(g)?2NO2(g) △H>0且平衡体系的总质量(m总 )与总物质的量(n总)之比在不同温度下随压强变化曲线如图所示,下列说法正确的是(? )
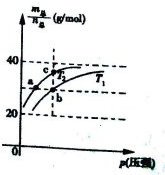
A.平衡常数K(a)=K(b)<K(c)
B.反应速率:va<vb;
C.温度:T2>T1
D.当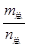 =69g/mol时,若n(NO2):n(N2O4)=2:1,
=69g/mol时,若n(NO2):n(N2O4)=2:1,