1、选择题 家用炒菜铁锅用水清洗后,放置一会出现红棕色的铁锈,在此变化过程中不会发生的化学变化是(?)
A.2Fe+ O2 + 2H2O=2Fe(OH)2
B.4Fe(OH)2+O2 +2H2O=4Fe(OH)3
C.O2 + 2H2O + 4e-→ 4OH-
D.Fe → Fe3++3e-
参考答案:D
本题解析:之所以出现红棕色的铁锈,是因为铁发生电化学腐蚀,铁作负极失去电子被氧化生成亚铁离子,在电化学中铁不可能直接生成Fe3+。答案是D。
本题难度:一般
2、填空题 (9分)下图所示水槽中试管内有一枚铁钉,放置数天后观察:
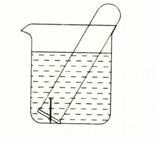
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于?腐蚀。
(2)若试管内液面上升,则原溶液呈?性,发生?腐蚀,正极反应式为?。
(3)若试管内液面下降,则原溶液呈?性,发生?腐蚀,正极反应式为?。
参考答案:(9分)
(1)电化学(2)弱酸性或中;吸氧);O2+2H2O+4e—====4OH—
(3)较强的酸;析氢;2H++2e—===H2 ↑
本题解析:(1)铁钉表面形成无数个微小的铁碳原电池,属于电化学腐蚀;
(2)若试管内液面上升,说明发生了吸氧腐蚀,溶液呈弱碱性,相关方程式:正极:O2+2H2O+4e—====4OH—;负极:Fe? -2e-=Fe2+;
(3)若试管内液面下降,说明发生了析氢腐蚀,溶液呈酸性;相关方程式:正极:2H++2e—===H2 ↑;负极:Fe? -2e-=Fe2+?。
本题难度:一般
3、填空题 如图,水槽中试管内有一枚铁钉,放置数天观察:
(1)若液面上升,则溶液呈______性,电极反应式为:
负极:______,
正极:______
(2)若液面下降,则溶液呈______性,电极反应式为:
负极:______,
正极:______.
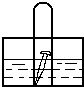
参考答案:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,
(1)若试管内液面上升,说明电解质环境是碱性或是中性,试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-═4OH-,
故答案为:碱性或是中性;2Fe-4e-=2Fe2+;2H2O+O2+4e-═4OH-;
(2)若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,正极上氢离子得电子发生还原反应,电极反应式为:4H++4e-═2H2↑,
故答案为:较强的酸;Fe-2e-═Fe2+;2H++2e-=H2↑.
本题解析:
本题难度:一般
4、选择题 表面镀有保护金属层的铁片,当镀层有破损时比普通铁片更易腐蚀的是( )
A.白铁(镀锌铁)
B.马口铁(镀锡铁)
C.镀铅铁
D.镀铜铁
参考答案:A、镀锌铁中,金属铁作正极,是被保护的电极,比普通铁片更耐腐蚀,故A错误;
B、镀锡铁中,金属铁作负极,是被腐蚀的电极,比普通铁片更易腐蚀,故B正确;
C、镀铅铁中,金属铁作正极,是被保护的电极,比普通铁片更耐腐蚀,故C错误;
D、镀铜铁中,金属铁作负极,是被腐蚀的电极,比普通铁片更易腐蚀,故D正确;
故选BD.
本题解析:
本题难度:一般
5、简答题 (1)埋在地下的钢铁管道容易腐蚀而损坏,其原因在哪里?
______________________________________________________________
(2)应采取何种措施保护埋在地下的管道?
______________________________________________________________
参考答案:(1)地下钢铁管道容易腐蚀的原因是发生电化学腐蚀
(2)可在管道外壁涂沥青保护层,使钢铁管道跟周围电解质溶液隔离开来,破坏原电池形成的条件,从而使地下钢铁管道得到保护(或:把比Fe更活泼的Zn连接在钢铁管道,Zn作为原电池的负极被腐蚀,而钢铁管道则被保护)(答案合理即可)
本题解析:
本题难度:一般