|
高考化学必考知识点《弱电解质电离平衡》高频试题强化练习(2017年最新版)(四)
2017-11-11 02:25:07
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号
| HA物质的量
浓度(mol·L-1)
| NaOH物质的量
浓度(mol·L-1)
| 混合溶液的pH
| 甲
| 0.2
| 0.2
| pH=a
| 乙
| C1
| 0.2
| pH=7
| 丙
| 0.2
| 0.1
| pH>7
| 丁
| 0.1
| 0.1
| pH=9
|
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,若a?7(填>、<或=),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度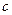 (A-)与 (A-)与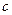 (Na+)的大小关系是?。 (Na+)的大小关系是?。
A.前者大
B.后者大
C.二者相等
D.无法判断
| (3)从丙组实验结果分析,HA是?酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是?。
(4)丁组实验所得混合溶液中由水电离出的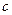  =?mol·L-1。 =?mol·L-1。
参考答案:(每小题3分)(1)>?(2)C?(3)弱? Na+>A->OH->H+?(4)10-5
本题解析:(1)若HA是弱酸,则恰好反应后是强碱弱酸溶液,呈碱性。(2)、根据电荷守恒有:c(Na+)+c(OH-)=c(H+)+c(A-) ,pH=7时,c(OH-)=c(H+),所以c(Na+)= c(A-)。
(3)丙组中HA酸过量,但溶液显碱性,所以HA是弱酸。
(4)因溶液pH=9,c(OH-)=10-6mol/L,全部来源于水的电离。
本题难度:一般
2、选择题 已知:7.2×10-4、4.6×10-4、4.9×10-10分别是同一条件、同一浓度的三种酸的电离平衡常数。不同的酸在 溶液中存在着较强酸可以制较弱酸的规律。若已知有如下反应:①NaCN+HNO2==HCN+NaNO2; ②NaCN+HF ==HCN+NaF;③NaNO2+HF==HNO2+NaF。在相同条件下,可得出的结论是
[? ]
A.HF的电离平衡常数为7.2×10-4
B.HNO2的电离能力比HCN的大,比HF的小
C.HNO2的电离平衡常数为4.9×10 -10
D.同浓度的HF和HNO2溶液的导电能力后者强
参考答案:AB
本题解析:
本题难度:一般
3、填空题 (8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸? Ka= 1.75×10-5
碳酸? Ka1= 4.30×10-7? Ka2 = 5.61×10-11
亚硫酸? Ka1= 1.54×10-2? Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = ??;
碳酸的第一步电离比第二步电离?(填“容易” 或 “困难”)。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:??>?>?
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是?(填序号)
A.c(CH3COO-)
B.c(H+)
C.醋酸的电离平衡常数
D.醋酸的电离度
参考答案:(1)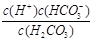 ?容易?(2)H2CO3 > HSO3- > HCO3-?(3) A D ?容易?(2)H2CO3 > HSO3- > HCO3-?(3) A D
本题解析:(1)碳酸的第一步电离方程式为H2CO3 H++HCO3-,所以电离平衡常数表达式为Ka1 = H++HCO3-,所以电离平衡常数表达式为Ka1 = 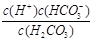 。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。 。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
(2)酸电离平衡常数越大,说明酸越强。所以根据电离平衡常数可知,H2CO3、HCO3-和HSO3-的酸性强弱顺序为H2CO3 > HSO3- > HCO3-。
(3)加入乙酸,增大氢离子浓度,抑制醋酸的电离,所以选项AD减小,B增大,C不变。
本题难度:一般
4、填空题 (8分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是?(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)?0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH?7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
A.NH4HCO3;
B.NH4A;
C.(NH4)2SO4;
D.NH4Cl,按pH由大到小的顺序排列(填序号)。
参考答案:(共8分,每空2分)(1)A-+H2O HA+OH- (2)> ?(3)> (4)A>B>D>C HA+OH- (2)> ?(3)> (4)A>B>D>C
本题解析:(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸,生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2O HA+OH-; HA+OH-;
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离出的c(H+)>0.1mol?L-1NaOH溶液中由水电离出的c(H+);
(3)将HA溶液加到Na2CO3溶液中有气体放出,说明HA的酸性比碳酸的强,NH4A溶液为中性,说明相同条件下,氨水和HA的电离程度相同,所以(NH4)2CO3中铵根离子的水解程度小于碳酸根离子的水解程度,所以溶液的pH>7;
(4)(NH4)2SO4和NH4Cl是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液中铵根离子浓度越大,水解程度越小,但水解的个数多,所以氯化铵溶液的pH值大于硫酸铵;NH4A溶液中阴阳离子的水解程度相等,所以溶液呈中性,溶液的pH值大于氯化铵;NH4HCO3溶液中铵根离子的水解程度小于碳酸氢根离子的水解程度,溶液呈碱性,所以溶液的pH值最大,故答案为:A>B>D>C。
本题难度:一般
5、选择题 下列说法不正确的是
A.配制FeCl2溶液时,可将FeCl2晶体先溶于浓盐酸,再加水稀释和少量铁屑保存
B.输油管道,为防止其表面被腐蚀应涂上隔水材料并与外电源负极相连
C.pH值均为9的NaOH溶液和Na2CO3溶液,两溶液中水的电离程度相同
D.0.1mol/L 弱酸HA溶液与0.05mol/L NaOH溶液等体积混合后所得溶液微粒浓度间有: 2c(H+)+c(HA) = c(A-)+2 c(OH-)
参考答案:C
本题解析:A正确,主要为了抑制氯化亚铁的水解;B正确,利用电化学反应将输油管道作为正极加以保护;氢氧化钠溶液中水的电离受到抑制,而碳酸钠溶液中因为水解促进里睡的电离,C错误。由c(H+)- c(OH-)=[c(A-)-c(HA)]/2知D正确。
本题难度:一般
| 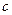
 =?mol·L-1。
=?mol·L-1。