1、选择题 下列物质中含有共价键的离子化合物是
[? ]
①MgF2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦Mg3N2
A.②③④
B.①③④⑦
C.①②④⑦
D.③④⑥
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列化学用语正确的是?
[? ]
A.S2-的原子结构示意图为?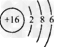
B.碳—12可表示为12C ?
C.—OH的电子式为? ?
?
D.NaCl的分子式为NaCl
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列化学用语书写正确的是( )
A.氯原子的结构示意图:
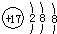
B.含有6个中子的碳核素:614C
C.+3价的氮氧化物的分子式:N2O3
D.漂白粉有效成分的化学式:CaCl2
参考答案:C
本题解析:
本题难度:简单
4、填空题 (9分)原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
?
| A
| B
| C
| D
| E
| F
|
主要化合价
| -1
| -3? +5
| -2? +6
| -1? +7
| +2
| +1? +2
|
原子半径
| 0.071
| 0.11
| 0.102
| 0.099
| 0.197
| 0.117
|
(1)B、C、D三种元素第一电离能数值由小到大的顺序是?(填元素符号);
(2)B的氢化物中心原子采取?杂化,空间构型是?形,是?分子(填“极性”或“非极性”);
(3)F2+与NH3 形成配离子的结构式为?;往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式?。
(4)A 、E两种元素形成晶体晶胞是下图中的?(填①、②、③或④);

①?②?③?④?
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线?(填n、m、x或y)。
参考答案:(9分)⑴? S<P<Cl (1分)?⑵? Sp3 ?三角锥?极性(各1分,共3分)
⑶? [Cu(NH3)4]2+(1分),Cu(OH)2+ 4NH3·H2O = [Cu(NH3)4]2+ + 2OH-+ 4H2O (2分)
⑷? ②?(1分)⑸? n(1分)
本题解析:F+的三个能层电子全充满,且位于第四周期,所以根据F的主要化合价可知,F是铜。E的原子半径大于铜的,也位于第四周期,主要化合价是+2价,所以E是钙。根据短周期元素A、B、C、D的主要化合价和原子半径可知,A是F,B是P,C是S,D是Cl。
(1)非金属性越强,第一电离能越大,但由于P元素的3p轨道电子处于半充满状态,其第一电离能大于S元素的,即S<P<Cl。
(2)PH3分子中P原子含有(5-1×3)÷2=1对孤对电子,所以是三角锥形结构,属于极性分子,P原子是sp3杂化。
(3)铜离子和氨气能形成配位键,其化学式是 [Cu(NH3)4]2+。由于铜离子和氨气能形成配位键,属于氢氧化铜能溶解在氨水中,反应的离子方程式是Cu(OH)2+ 4NH3·H2O = [Cu(NH3)4]2+ + 2OH-+ 4H2O。
(4)CaF2形成的晶体是离子晶体,其晶胞是②,答案选②。
(5)由于水分子间存在氢键,其熔沸点最高,所以符合S的氢化物的曲线应该是n。
点评:该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
5、简答题 X是由两种短周期元素构成的离子化合物,1mol?X含有20mol?电子.下列说法不正确的是( )
A.晶体中阳离子和阴离子所含电子数一定相等
B.晶体中一定只有离子键没有共价键
C.所含元素一定不在同一周期也不在第一周期
D.晶体中阳离子半径一定小于阴离子半径
参考答案:X由两种短周期元素构成且为离子化合物,1mol?X含有20mol电子.短周期元素中只有ⅠA、ⅡA与ⅥA、ⅦA元素之间可以形成离子化合物,
A.当由ⅠA族和ⅦA族形成X时,只可能为NaF晶体中阴阳两种离子所含的电子数均为10,但LiCl中锂离子只有2个电子而氯离子中有18个电子,故A错误;
B.当由ⅡA与ⅥA族元素形成X时,只可能为MgO,其晶体中阳离子和阴离子所含电子数相等,双核离子化合物一定含有离子键不含共价键,故B正确;
C.离子化合物可能为NaF、LiCl、MgO,所含元素一定不在同一周期也不在第一周期,故C正确;
D.核外电子排布相同的离子,其核电荷数越小,离子半径越大,则晶体中阳离子半径一定小于阴离子半径,故D正确;
故选A.
本题解析:
本题难度:一般