1、选择题 在恒温恒压的条件下,一密闭容器内发生反应:2NO2(g)  N2O4(g),达平衡时,再向容器内通入一定量的NO2(g),重达平衡后,与第一次平衡时相比,NO2的体积分数(?)
N2O4(g),达平衡时,再向容器内通入一定量的NO2(g),重达平衡后,与第一次平衡时相比,NO2的体积分数(?)
A.不变
B.增大
C.减小
D.无法判 断
参考答案:A
本题解析:略
本题难度:简单
2、选择题 下列有关平衡常数的说法正确的是
A.已知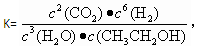 则对应的化学反应可以表示为:
则对应的化学反应可以表示为:
2CO2(g) + 6H2(g) 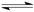 CH3CH2OH(g) + 3H2O(g)
CH3CH2OH(g) + 3H2O(g)
B.将某浓度醋酸溶液升高温度,醋酸的电离平衡常数Ka将变大
C.常温下,向纯水中加入少量碳酸钠固体,水的电离程度变大,Kw变大
D.常温下,在饱和氯水中加入少量碳酸钙固体,Cl2+H2O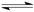 HCl+HClO平衡正移,平衡常数K变大
HCl+HClO平衡正移,平衡常数K变大
参考答案:B
本题解析:A、分子为生成物,分母为反应物;
B、电离吸热,温度升高,电离常数变大;
C、Kw只与温度有关,温度不变,Kw不变;
D、K只与温度有关,温度不变,K不变;
本题难度:一般
3、选择题 在一定温度下的定容容器中,当下列物理量不再发生变化时,表明反应A(s)+2B(g)  ?C(g)+D(g) 已达到化学平衡状态的是
?C(g)+D(g) 已达到化学平衡状态的是
①混合气体的压强?②混合气体的密度
③B的物质的量浓度?④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值?⑦混合气体总质量
A.②③⑤⑦? B.③④⑤⑥? C.①③④⑤? D.①④⑦
参考答案:A
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以③正确。反应前后气体体积不变,因此物质的量和压强始终是不变的,但质量是变化的,①④不正确,⑦正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,所以②正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,物质的量不变,但质量是变化的,所以⑤可以说明。速率之比是相应的化学计量数之比,因此⑥中的关系始终是成立,不正确。答案选A。
本题难度:简单
4、选择题 下列说法能表示可逆反应N2+3H2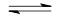 2NH3处于平衡状态的是
2NH3处于平衡状态的是
A.3mol氢气和1mol氮气恰好完全反应,得到2mol氨气
B.正反应生成NH3的速率和逆反应生成H2的速率相等
C.单位时间消耗n mol N2的同时消耗2n mol NH3
D.N2、H2、NH3的质量分数相等
参考答案:C
本题解析:该反应是可逆反应,不能彻底反应,故不可能得到2mol氨气,故A错误;正反应生成NH3的速率和逆反应生成H2的速率之比为2:3,才达到平衡状态,B错;平衡状态时,各物质的质量分数保持不变,但是不一定相等,D错。
点评:判断一个反应是否达到平衡状态,是历年高考的重点。考生在备考过程中应抓住实质、通过标志进行分析。难度中等,一般以选择题出现。
本题难度:一般
5、选择题 在一定条件下,向5L密闭容器中充入2mol?A气体和1mol?B气体,发生可逆反应:2A(g)+B(g)?2C(g),达到平衡时B的浓度为0.1mol/L,则A的转化率为( )
A.67%
B.50%
C.25%
D.缺少条件无法计算
参考答案:平衡时B的物质的量为0.1mol/L×5L=0.5mol,则
?2A(g)+B(g)?2C(g)
起始量(mol)? 2? 1? 0
变化量(mol)? 1?0.5? 1
平衡量(mol)?1?0.5? 1
则A的转化率=1mol2mol×100%=50%,
故选B.
本题解析:
本题难度:一般