1、选择题 将1 mol SO2和1mol O2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5 mol O2和0.5 mol SO2,则重新达到平衡后,SO3的物质的量
A.等于0.3 mol
B.等于0.15 mol
C.小于0.15 mol
D.大于0.15 mol,小于0.3 mol
参考答案:C
本题解析:移走0.5 mol O2和0.5 mol SO2相当于对容器进行减压一半操作,因此平衡逆向移动,所以SO3的物质的量小于0.15 mol。答案选C。
点评:改变影响移动的一个条件,平衡向减弱这种改变的方向移动。
本题难度:一般
2、填空题 (6分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s)
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)(mol)
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
(1)NO的平衡浓度c(NO)=?。
(2)图中表示NO2变化的曲线是?。
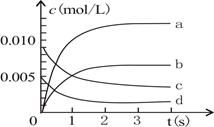
(3)能说明该反应已达到平衡状态的是?。
a.v(NO2)=2v(O2)?
b.容器内气体总物质的量保持不变
c.v逆?(NO)=2v正(O2)?
d.容器内气体的密度保持不变
参考答案:⑴? 3.5×10-3mol·L-1?(2)b?(3)b c
本题解析:(1)根据表中数据可知,平衡是NO的物质的量是0.007mol,容积是2L,所以浓度为3.5×10-3mol·L-1。
(2)根据表中数据可知,平时消耗NO的物质的量是0.020mol-0.007mol=0.013mol。所以生成NO2的物质的量也是0.013mol,浓度是6.5×10-3mol·L-1。所以曲线b是正确的。
(3)a不正确,在任何时刻v(NO2)=2v(O2)恒成立。但c是正确的,因为反应速率的方向相反,且满足速率之比是相应的化学计量数之比。反应前后体积是减小的,所以物质的量也是减小的。因此当容器内气体总物质的量保持不变时,可以说明。密度是混合气的质量和容器容积的比值,在反应过程中,这二者均是不变的,所以密度始终不变,d不能说明。答案选bc。
本题难度:一般
3、选择题 下列事实中,不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O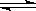 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g) 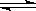 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
C.反应CO+NO2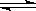 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
参考答案:B
本题解析:略
本题难度:一般
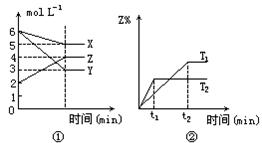
4、选择题 符合下图反应的是(T1、T2表示不同的温度)
A.X+3Y 2Z-Q
2Z-Q
B.X+3Y 2Z+Q
2Z+Q
C.X+2Y 3Z+Q
3Z+Q
D.5X+3Y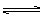 4Z+Q
4Z+Q
参考答案:B
本题解析:本题给出了众多的曲线图像,要求学生判断符合图像的化学反应,从而以考查学生的观察能力。解答本题的关键是正确观察出图像的曲线,并弄清各图像的内在含义。图像①表示的是反应物X、Y生成Z时,从起始到建立平衡各物质浓度的变化。根据变化量成比例很容易写出X+3Y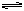 2Z。图像②表示的是在不同温度下,从X、Y开始生成Z,建立平衡时Z%与时间的关系。根据该图像,可判断出T2>T1,高温时Z%低,故该反应应为放热反应,综合上述分析,可选B。
2Z。图像②表示的是在不同温度下,从X、Y开始生成Z,建立平衡时Z%与时间的关系。根据该图像,可判断出T2>T1,高温时Z%低,故该反应应为放热反应,综合上述分析,可选B。
本题难度:一般
5、选择题 将4molA气体和2molB气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)=2C(g).若经2s后测得C的浓度为1.2mol/L,下列说法正确的是( ? )
A.用物质A表示的反应速率为1.2mol/(L?s)
B.用物质B表示的反应速率为0.6mol/(L?s)
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.6mol/L
参考答案:C
本题解析:
本题难度:简单