|
高考化学知识点归纳《物质的量》考点预测(2017年强化版)(十)
2017-11-11 02:34:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 有五种物质是:①0.5molCO2 ②6gH2 ③10mlH2O(4°C) ④1.204×1024个HCl ⑤147gH2SO4,它们中物质的量最大的是_________,所含分子数最多的是_________,含有原子数最多的是_________,质量最大的是_________。(用序号填空)
参考答案:②;②;⑤;⑤
本题解析:
本题难度:一般
2、选择题 下列溶液中,c(Cl-)的大小顺序为 (用字母填写)
A.20 mL 0.4 mol/L AlCl3溶液
B.30 mL 1.5 mol/L KCl溶液
C.7.5 mL 1 mol/L MgCl2溶液
D.10 mL 2 mol/L NaCl溶液
|
参考答案:24. A<B<C=" D"
本题解析:在盐溶液中,离子的浓度与盐的浓度、盐的化学式中离子的个数有关,与溶液的体积无关,根据离子的浓度=盐的浓度X盐的化学式中离子的个数,可得A、0.4 mol/L AlCl3溶液中 c(Cl-)=3c(AlCl3)=1.2mol/L;B、1.5 mol/L KCl溶液中c(Cl-)=c(KCl)=1.5mol/L;C、1 mol/L MgCl2溶液中c(Cl-)=2c(MgCl2)=2mol/L;D、2 mol/L NaCl溶液中c(Cl-)=c(NaCl)=2mol/L;c(Cl-)的大小顺序为A<B<C= D。
考点:考查离子浓度的计算。
本题难度:一般
3、填空题 在t℃时,a g 某化合物的饱和溶液的体积为b mL,将其蒸干后得到c g摩尔质量为 d g/mol的不含结晶水的固体物质。计算:(1)此物质在t℃时的溶解度
(2)在t℃时此化合物的饱和溶液中溶质物质的量浓度。
参考答案:(1)100C/(a-c)?(2)1000c/bd
本题解析:略
本题难度:简单
4、计算题 (本题共14分)铜有多种化合物,氧化亚铜(Cu2O)、氯化亚铜(CuCl)、氯化铜(CuCl2)、CuSO4等。
完成下列计算:
(1)波尔多液是由硫酸铜、生石灰和水配制成的杀菌剂,不同情况下需要配制不同的比例。现配制按质量比CuSO4:CaO:H2O =1:2:200的波尔多液50Kg。
需要用CuSO4·5H2O g,CaO mol
(2)某工厂以精辉铜矿(主要成分为Cu2S)为原料冶炼金属铜,精辉铜矿中含23%杂质,日均产含Cu量97.5%的粗铜42t。
已知:总反应式 Cu2S+O2 2Cu+SO2 2Cu+SO2
日均需精辉铜矿 t,日均产SO2标准状况下体积 L
(3)印刷线路板的铜能被FeCl3的溶液腐蚀,将印刷线路板浸入200mL FeCl3溶液中,有11.2gCu被腐蚀掉。取出印刷线路板,向溶液中加入11.2g铁粉,充分反应溶液中还有4.8g不溶物。计算原FeCl3溶液的物质的量浓度。
(4)制备铜的某化合物晶体。取5.12g Cu、14.5mol/L HNO3 15 mL、6.0 mol/L HC1 50mL,混合后Cu完全反应,反应后溶液有中水54.32g,再经水浴保温蒸发掉42g水,冷却至20℃并过滤,得到8.12g晶体。通过计算推断此晶体的化学式 。
已知:20℃溶解度 CuC12·2H2O 73g /100g H2O Cu(NO3)2·3H2O 125g /100g H2O
参考答案:(本题共14分)
(1)385 (1分) 8.8 (1分)
(2)66.5 (2分) 7.17×106 (2分)
(3)剩余不溶物Cu 共溶解Cu: 11.2—4.8=5.6g 物质的量 6.4 /64=0.1mol (1分)
Fe: 11.2g 物质的量 11.2 /56=0.2mol (1分)
C(FeCl3)=0.6mol/0. 2L=3.0mol/L(1分)
(4)混合后反应Cu+NO3-+H+?Cu2++H2O+N O x↑
剩余硝酸根量少且Cu(NO3)2·3H2O溶解度大,析出的是CuC12晶体(1分)
设晶体化学式为CuC12·xH2O
无水CuC12 20℃溶解度 为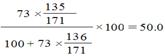 g /100g H2O (1分) g /100g H2O (1分)
生成CuC12 5.12?135/64= 10.8g,剩余水54.32—42=12.32g
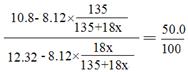 (2分) x=3 CuC12·3H2O (1分) (2分) x=3 CuC12·3H2O (1分)
本题解析:(1)CuSO4:CaO:H2O =1:2:200的波尔多液50Kg中硫酸铜的质量是50kg×1/(1+2+200)=246.3g,则硫酸铜的物质的量是246.3g/160g/mol,所以需要CuSO4·5H2O的质量是246.3g/160g/mol×250g/mol=385g;CaO的质量是硫酸铜质量的2倍,所以CaO的物质的量是246.3g×2/56g/mol=8.8mol;
(2)日均产含Cu量97.5%的粗铜42t,则Cu的物质的量是42×106g/64g/mol×97.5%=6.4×105mol,根据化学方程式可知需要Cu2S的物质的量是3.2×105mol,所以日均需精辉铜矿的质量是3.2×105mol×160g/mol/(1-23%)=66.5t;日均生成二氧化硫的物质的量也是3.2×105mol,标准状况下的体积是3.2×105mol×22.4L/mol=7.17×106L;
(3)根据题意,剩余不溶物只能是Cu,不可能含有Fe;若存在Fe,则溶液中的铜离子被全部置换出,则不溶物的质量大于11.2g;4.8gCu的物质的量是0.075mol,开始加入Cu的物质的量是11.2g/64g/mol=0.175mol,所以相当于溶解Cu0.1mol,Fe的物质的量是11.2g/56g/mol=0.2mol,则gauge过程中共失去电子的物质的量是(0.2+0.1)mol×2=0.6mol,根据得失电子守恒,则铁离子的物质的量是0.6mol,所以氯化铁溶液的物质的量浓度是0.6mol/0.2L=3.0mol/L;
(4)根据题意,Cu与氢离子、硝酸根离子反应生成铜离子、氮的氧化物、水,氯离子不参加反应,反应前n(HNO3)=0.2175mol,n(HCl)=0.3mol,n(Cu)=5.12g/64g/mol=0.08mol,所以剩余硝酸根量少于氯离子,且Cu(NO3)2·3H2O溶解度大,则析出的是CuC12晶体;无水氯化铜的溶解度是 g; g;
设晶体化学式为CuC12·xH2O,反应生成氯化铜的质量是0.08mol×135g/mol=10.8g,剩余水的质量是54.32g-42g=12.32g,析出晶体后剩余溶液为氯化铜的饱和溶液,则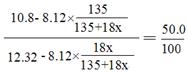 ,解得x=3,该晶体的化学式为CuC12·3H2O。 ,解得x=3,该晶体的化学式为CuC12·3H2O。
考点:考查物质化学式的计算,以物质的量为核心的有关计算
本题难度:困难
5、选择题 36 g 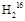 O与80 g O与80 g 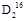 O的物质的量之比是 ,分子中所含质子数之比是 ,所含中子数之比是 ,它们分别与Na反应时,所放出气体体积之比(同条件)是 ,质量之比是 。? O的物质的量之比是 ,分子中所含质子数之比是 ,所含中子数之比是 ,它们分别与Na反应时,所放出气体体积之比(同条件)是 ,质量之比是 。?
参考答案:1∶2 1∶2 2∶5 1∶2 1∶4
本题解析: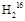 O和 O和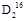 O的相对分子质量分别为18和20,所以其物质的量分别为2 mol和4 mol,质子的物质的量分别为20 mol和40 mol,中子的物质的量分别为16 mol和40 mol,与钠反应生成的气体物质的量之比与水的物质的量之比相同,气体质量之比等于气体物质的量之比再分别乘以其摩尔质量。 O的相对分子质量分别为18和20,所以其物质的量分别为2 mol和4 mol,质子的物质的量分别为20 mol和40 mol,中子的物质的量分别为16 mol和40 mol,与钠反应生成的气体物质的量之比与水的物质的量之比相同,气体质量之比等于气体物质的量之比再分别乘以其摩尔质量。
本题难度:一般
|