1、选择题 (NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O将反应后的混合气体通入足量的BaCl2溶液,产生的沉淀为
[? ]
A.BaSO4
B.BaSO3
C.BaSO4和BaSO3
D.BaS
参考答案:C
本题解析:
本题难度:一般
2、选择题 “PM2.5”是指大气中直径小于或等于2.5微米的颗粒物.它与空气中的SO2接触时,SO2会部分转化为SO3.则“PM2.5”的颗粒物在酸雨形成过程中主要的作用是下列的( )
A.还原作用
B.氧化作用
C.催化作用
D.抑制作用
参考答案:C
本题解析:
本题难度:简单
3、填空题 保护环境、保护地球已成为人类共同的呼声.
(1)酸雨的pH小于5.6,下列气体排放可能会形成酸雨的是______
A、N2?B、CO?C、SO2?D、氟氯代烷
(2)下列措施不利于环境保护的是______
A、推广使用无铅汽油?B、提倡使用太阳能
C、推广使用无磷洗衣粉?D、提倡个人使用大批量汽车.
参考答案:(1)因化石燃料燃烧生成二氧化硫、二氧化氮等酸性氧化物是形成酸雨的主要气体,故答案为:C;
(2)含磷洗衣粉能使水体富营养化造成赤潮、水华现象发生;含铅汽油能污染空气;提倡使用太阳能,可以减少化石燃料的使用,减少污染物的产生;提倡个人使用大批量汽车,会消耗更多的燃料,产生污染物,故答案为:D.
本题解析:
本题难度:简单
4、填空题 近年来,为提高能源利用率,西方提出共生系统.特指为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的______极(填“正”或“负”),负极反应式为______.用这种方法处理SO2废气的优点是______.
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如图:
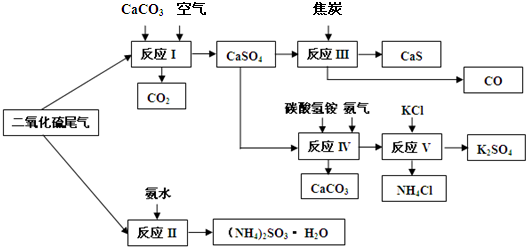
①生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是______.
②下列有关说法正确的是______.
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应III中发生反应的化学方程式为CaSO4+4C
CaS+4CO↑
C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应V中的副产物氯化铵可用作氮肥
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是______.
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式______.
参考答案:(1)利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,原电池反应是负极发生氧化反应,正极发生还原反应,依据元素化合价变化可知,二氧化硫中硫元素化合价升高,失去电子发生氧化反应,过程中,将SO2通入电池的负极,电极反应为:SO2+2H2O-2e-=SO42-+4H+;此方法的优点是污染小,生成产物可以循环利用,可以回收有效能;
故答案为:负;SO2+2H2O-2e-=SO42-+4H+;利用上述电池,可回收大量有效能,副产品为H2SO4,减少环境污染,实现(能质)共生;
(2)①向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,防止亚硫酸根被氧化,以更好的得到亚硫酸铵晶体;
故答案为:防止亚硫酸铵被氧化;
②A、依据流程图结合反应生成物分析,过量的空气把亚硫酸钙氧化为硫酸钙;故A正确;
B、依据流程图中的反应物和生成物,结合元素化合价变化分析写出反应的化学方程式为CaSO4+4C?高温?.?CaS+4CO↑;故D正确;
C、防止碳酸氢铵在温度过高时分解得不到需要的目标产物;故C正确;
D、氯化铵是一种氮肥;故D正确;
故答案为:ABCD;
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是利用乙二醇降低硫酸钾溶解度,有利于析出;
故答案为:K2SO4在有机溶剂乙二醇中溶解度小,能充分析出;
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,原子守恒配平书写出的化学方程式为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2;
故答案为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2;
本题解析:
本题难度:一般
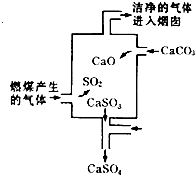
5、选择题 如图是某煤发电厂处理废气的装置示意图.下列说法错误的是( )
A.使用此废气处理装置可减少酸雨的形成
B.装置内发生的反应有化合、分解、置换和氧化还原反应
C.整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2
D.可用酸性高锰酸钾溶液检验废气处理是否达标