1、选择题 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是
?
A.T的氧化物是光导纤维的主要成分
B.W的氢化物的化学式为HCl
C.R的最高正价氧化物的水化物是弱电解质
D.Q与氢形成的化合物均含极性共价键
参考答案:D
本题解析:图中位于第三周期第IIIA族元素T为铝,以此为突破口,可以顺利推导出Q、R、W分别为碳、氮、硫。T是铝,铝的氧化物为氧化铝,光导纤维的主要成分是二氧化硅,故A项错误;W是硫,硫的氢化物为硫化氢(H2S),故B项错误;R是氮,氮元素最高正价氧化物的水化物是硝酸(HNO3),硝酸是强酸、强电解质,故C项错误;Q是碳,碳与氢形成的化合物成为烃,烃分子中一定含有C—H键,碳、氢是不同非金属,则C—H键是极性共价键,故D项错误。
本题难度:简单
2、填空题 (1)原子核内无中子的元素可放在元素周期表的?族,又根据最高正化合价和负化合价的绝对值相等可放在?族,该元素还可放在元素周期表的?族。它的核外电子排布式为?,它和氧元素可形成的化合物的电子式为?。
(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”。
 ?
?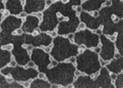 ?
?
A? B
则A、B两幅图中能表示“热冰”的示意图为?。使水结成“热冰”采用“弱电场”的条件,说明水分子是?分子。(选填“极性”或“非极性”)
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+)。这种阳离子具有较强的氧化性,试写出该离子与H2S的水溶液反应的离子方程式?;该反应破坏的化学键是?。
参考答案:

本题解析:略
本题难度:一般
3、选择题 下列分子中所标注的原子不采取sp3杂化的是
A.手性碳原子
B.NO2-中的氮原子
C.ClO3-中的氯原子
D.NH2-中的氮原子
参考答案:B
本题解析:根据手性碳原子(连接4个不同的原子或原子团)的定义可知该碳原子为sp3杂化。NO2-离子中孤对电子数(5-2×2+1)/2=1,成键原子数2个,故N原子采用sp2杂化,同理分析可知选项C和D中所标注的原子均采取sp3杂化。
本题难度:一般
4、实验题 某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
实验步骤
| 实验现象
|
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液
| A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色
|
②向新制得的Na2S溶液中滴加新制的氯水
| B.有气体产生,溶液变成浅红色
|
③将一小块金属钠放入滴有酚酞溶液的冷水中
| C.剧烈反应,迅速产生大量无色气体
|
④将镁条投入稀盐酸中
| D.反应不十分剧烈;产生无色气体
|
⑤将铝条投入稀盐酸中
| E.生成白色胶状沉淀,继而沉淀消失
|
⑥向AlCl3溶液中滴加NaOH溶液至过量
| F.生成淡黄色沉淀
|
?
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
实验内容
| ①
| ②
| ③
| ④
| ⑤
| ⑥
|
实验现象(填A~F)
| ?
| ?
| ?
| ?
| ?
| ?
|
?
(2)实验结论: 。?
参考答案:(1)(每空1分,共6分)
实验内容
①
②
③
④
⑤
⑥
实验现象
B
F
A
C
D
E
?
(2)金属性:Na>Mg>Al(1分),非金属性Cl>S(1分)或:同周期元素随着核电荷数的递增,金属性逐渐减弱,非金属性逐渐增强(2分)
本题解析:本题考查第三周期元素的性质及金属性、非金属性强弱的比较方法。
本题难度:一般
5、选择题 已知短周期元素X、Y、Z在元素周期表中的位置如下图,下列说法正确的是( )
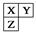
A.原子半径:Z>Y>X
B.X元素属于第二周期
C.气态氢化物的稳定性:X>Y>Z
D.最高价氧化物对应水化物的酸性:Y>Z>X
参考答案:B
本题解析:A项:原子半径:Z>X>Y,故错;C项:气态氢化物的稳定性:Y>X>Z故错;D项:最高价氧化物对应水化物的酸性:Y>X>Z,故错。故选B。
点评:本题考查元素的位置、性质的相互关系及应用,题目难度不大,注意元素周期表中元素位置和性质的关系来解答。
本题难度:简单