1、选择题 下列原子的价电子排布中,对应于第一电离能最大的是(? )
A.4s24p1
B.3s23p2
C.2s22p3
D.3s23p3
参考答案:C
本题解析:选项C中2p轨道电子处于半充满状态,稳定性强,所以第一电离能最大,答案选C。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的考查。该题的关键是明确第一电离能的含义以及影响因素,然后结合题意灵活运用即可。
本题难度:简单
2、选择题 若能发现第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子层,且最外层有7个电子。下列叙述中正确的是( )。
A.此X元素的气态氢化物的化学式为HX,在常温下很稳定
B.其单质带有金属光泽,具有强氧化性,可与KI发生置换反应生成I2
C.其单质的分子式为X2,易溶于有机溶剂
D.AgX是一种有色的易溶于水的化合物
参考答案:C
本题解析:因为此X显-1价,所以X元素的气态氢化物的化学式为HX,但由于X的非金属性很弱,所以HX在常温下很不稳定,A错误;X单质氧化性比碘弱。不可与KI发生置换反应,B错误;类比Br2、I2等,C正确;类比AgCl、AgBr等,D错误。
本题难度:一般
3、选择题 下列有关原子结构和元素周期律的表述正确的是
A.原子序数为15的元素最高化合价为+5
B.同周期元素中,VIIA族元素是非金属性最强的元素
C.氧原子半径比氟原子半径大
D.原子序数为12的元素位于元素周期表的第三周期IIA族
参考答案:ABCD
本题解析:原子序数为15的元素是磷元素,其核外电子排布为2 8 5,最高化合价=最外层电子数,故A正确;
同周期,由左到右,原子的得电子能力逐渐增强,则元素的非金属性逐渐增强(惰性气体元素除外),故B正确;
同周期,由左到右,原子半径逐渐减小,故C正确;
原子序数为12的元素是镁元素,其核外电子排布为2 8 2,周期序数=电子层数、主族序数=最外层电子数,故D正确;
本题难度:一般
4、选择题 下列关于元素周期表的说法正确的是
A.元素周期表是按照元素相对原子质量大小排列而成的
B.元素周期表有7个横行,也是7个周期;有18个纵行,即18个族
C.凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8
D.凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多
参考答案:D
本题解析:本题考查元素周期表的结构及意义
元素周期表是按照元素的原子序数的大小排列而成的,故A错;
元素周期表有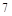 个周期,
个周期,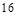 个族,故B错;
个族,故B错;
凡是位于元素周期表中同一周期的元素,电子层数均相同,短周期的元素从左到右的顺序原子最外层电子数由1递增到8,但长周期元素无此结论,故C错
凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多,D正确
故正确答案为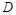
本题难度:一般
5、实验题 (共9分)某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)为了用实验的方法验证镁和铝的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)以上两实验方案实验现象较为明显的是方案?。
(2)学生乙在实验中取了一段黑色的镁带,投入稀盐酸中,现象不十分明显,请分析原因?。
(3)学生内另辟蹊径,不用镁、铝的单质,而用镁、铝的可溶盐及一些其它化学试剂,进行实验也得出正确的结论,简述学生丙用的是什么方法?

(Ⅱ)学生丁设计了下图装置以验证氮、碳、硅元素的非金属性强弱。他设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
(1)A写出所选用物质的化学式:
A:?,
B:?。
(2)写出烧杯中发生反应的离子方程式:?。
参考答案:
(Ⅰ)(1)方案二(1分)
(2)未除去镁表面的氧化膜(2分)
(3)取镁、铝的可溶盐逐滴加氢氧化钠溶液均产生氢氧化物沉淀,过量碱液可使生成的Al(OH),溶解,而Mg(OH)2则不溶。(2分)
(Ⅱ)、(1)HNO3;CaCO3(2分)
(2)CO2+SiO32-+H2O=H2SiO3↓+CO32-
或:2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3-?(2分)
本题解析:略
本题难度:简单