|
高中化学知识点大全《反应速率与平衡的有关计算》高频试题巩固(2017年最新版)(八)
2017-11-11 02:44:25
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 将1mol SO2和1mol O2通入容积固定的密闭容器中,在一定条件下反应达到平衡,平衡时SO3物质的量为0.3mol。此时若移走0.5mol SO2和0.5mol O2,则反应达到新平衡时SO3的物质的量是?(?)
A.0.3mol
B.0.15mol
C.小于0.15mol
D.大于0.15mol且小于0.3mol
参考答案:C
本题解析:略
本题难度:一般
2、简答题 甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g)?△H1?
②2CO(g)+O2(g) =2CO2(g)?△H2
③2H2(g)+O2(g)=2H2O(g)?△H3
则CO(g) + 2H2(g)  CH3OH(g) △H=?。 CH3OH(g) △H=?。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H??0(填>、<或=)。 CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H??0(填>、<或=)。

(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
| E.将甲醇从混合体系中分离出来
(4)CH4和H2O在催化剂表面发生反应CH4+H2O CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数??(结果保留小数点后两位数字)。 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数??(结果保留小数点后两位数字)。
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极的电极反应式为?。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole-时,实际上消耗的甲醇的质量比理论上大,可能原因是?。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀??(填“能”或“否”)。
参考答案:(1)△H1+1/2△H2-1/2△H3
(2 <
(3)ABE
(4)6.75?
(5)① CH3OH+3O2-6e-= CO2+ 2H2O;?
②甲醇不完全被氧化,生成C或CO?或电池能量转化率达不到100%
(6)否
本题解析:(1)①+1/2②—1/2③。整理可得:CO(g)+ 2H2(g) CH3OH(g)△H=△H1+1/2△H2-1/2△H3。 CH3OH(g)△H=△H1+1/2△H2-1/2△H3。
(2)由图像可以看出:升高温度,平衡时CH3OH的含量降低,说明升高温度,化学平衡向逆反应方向移动,根据平衡移动原理,升高温度化学平衡向吸热反应方向移动,逆反应方向为吸热反应,所以正反应为放热反应。因此△H<0。
(3)若要提高甲醇的产率,应该使平衡正向移动。由于该反应的正反应为气体体积缩小的放热反应,根据平衡移动原理,降低温度、增大压强(即缩小容器体积)增大反应物的浓度或把甲醇从反应体系中分离出来。因此选项为A、B、E。
(4)根据反应方程式CH4+H2O CO+3H2中各种物质的相互关系及甲烷的转化率可知:当反应达到平衡时,c(CH4)=0.5mol/L;c(H2O)=0.5mol/L;c(CO)=0.5mol/L;c(H2)=1.5mol/L.化学平衡状态是可逆反应达到平衡状态时,各种生成物浓度幂指数的乘积一各种反应物浓度幂指数乘积的比,所以 CO+3H2中各种物质的相互关系及甲烷的转化率可知:当反应达到平衡时,c(CH4)=0.5mol/L;c(H2O)=0.5mol/L;c(CO)=0.5mol/L;c(H2)=1.5mol/L.化学平衡状态是可逆反应达到平衡状态时,各种生成物浓度幂指数的乘积一各种反应物浓度幂指数乘积的比,所以
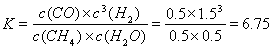 。 。
(5)①通入甲醇的电极B为原电池的负极, B极的电极反应式为CH3OH + 3O2-6e-= CO2+ 2H2O; 通入氧气的电极为正极,正极发生反应:O2+ 4e-= 2O2-。
②当电路中转移1mole-时,实际上消耗的甲醇的质量比理论上大,可能原因是甲醇不完全被氧化,生成C或CO或电池能量转化率达不到100%等。
(6)碳酸钙的Ksp=2.5×10-9,则c(Ca2+)·c(CO32-)=Ksp, c(Ca2+)=Ksp1/2=(2.5×10-9)1/2=5×10-5,当向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml 时,c(Ca2+)·c(C2O42-)=(1/2×5×10-5) ×(1/2×8.0×10-4)=10-8,小于草酸钙的Ksp=4.0×10-8,所以不能产生草酸钙沉淀。
本题难度:一般
3、填空题 N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在恒容密闭容器中N2O5可发生下列反应: 2N2O5(g) ≒ 4NO2(g) + O2(g).△H﹥0
(1)反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”、“减小”、“不变”)。
(2)下表为反应在T1温度下的部分实验数据:
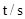
| 0
| 500
| 1000
| 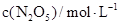
| 5.00
| 3.52
| 2.48
|
则,500s内N2O5的分解速率为_______________。
(3)在T2温度下,反应1000 s时测得NO2的浓度为4.98mol·L-1。则T2 __________ T1。(填“大于”“等于”或“小于”)
参考答案:(1) 不变.? (2) 2.96×10-3mol/(L.S).? (3) 小于
本题解析:(1)加入氮气,但不能改变反应物和生成物的浓度,因此平衡不移动,N2O5的转化率不变。
(2)500s内N2O5的浓度减少了(5.00-3.52)mol/L,所以其反应速率是1.48mol/L÷500s= 2.96×10-3mol/(L.S)。
(3)正反应是吸热反应,所以升高温度,平衡向正反应方向进行,NO2的浓度增大。但在温度为T1时,NO2的浓度是5.04mol/L,这说明T2小于T1。
本题难度:一般
4、填空题 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________?,
K值的大小与温度的关系是:温度升高,K值__________?(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)高炉炼铁中发生的基本反应之一为:CO(g) + FeO(s)? ?CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。 ?CO2 (g)+ Fe(s)△H﹥0,其平衡常数可表示为K=c(CO2)/c(CO),已知1100℃时,K=0.263。
①升高温度,平衡移动达到新的平衡时,高炉内CO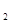 和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”); 和CO的体积比____________ (选填“增大”、“减小”或“不变”),平衡常数K值_____________(选填“增大”、“减小”或“不变”);
②1100℃时测得高炉中c(CO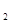 )="0.025" )="0.025" 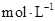 , ,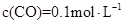 ,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度 ,此时,反应是否处于化学平衡状态__________ (选填“是”或“否”),化学反应速度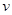 (正)__________ (正)__________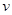 (逆)(选填“>”、“<”或“:”),其原因是________________。 (逆)(选填“>”、“<”或“:”),其原因是________________。
参考答案:(1)反应进行的越完全?可能增大也可能减小
(2)增大,增大
②否,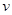 (正) > (正) >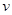 (逆),其原因是K>0.25 (逆),其原因是K>0.25
本题解析:(1)化学平衡常数K值越大,表示反应进行的越完全;对于有些反应来说,温度高,K大,对于另外的一些反应来说,温度高,K小,所以温度升高,K值可能增大也可能减小;(2) ①中,可以看出反应:CO(g) + FeO(s)? ?CO2 (g)+ Fe(s)△H﹥0,为吸热反应,升高温度,平衡右移,所以CO ?CO2 (g)+ Fe(s)△H﹥0,为吸热反应,升高温度,平衡右移,所以CO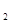 和CO的体积比增大,平衡常数K值也增大,②中1100℃时,K=0.263,所以K=c(CO2)/c(CO)= 0.025/0.1=0.25<0.263,所以还没有达到化学平衡,化学反应速度 和CO的体积比增大,平衡常数K值也增大,②中1100℃时,K=0.263,所以K=c(CO2)/c(CO)= 0.025/0.1=0.25<0.263,所以还没有达到化学平衡,化学反应速度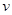 (正) > (正) >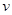 (逆),原因是K>0.25。 (逆),原因是K>0.25。
点评:该题考查化学平衡的移动,是高考的考查重点,该题的信息量较大,但是难度不大。
本题难度:一般
5、填空题 CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g)?△H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为?。
(2)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。 CH3CH2OH(g)+3H2O(g)。
 ?温度(K) ?温度(K)
CO2转化率(%)
n(H2)/n(CO2)
| 500
| 600
| 700
| 800
| 1.5
| 45
| 33
| 20
| 12
| 2
| 60
| 43
| 28
| 15
| 3
| 83
| 62
| 37
| 22
|
根据上表中数据分析:
①温度一定时,提高氢碳比[著轰击],CO2的转化率?(填“增大”“减小”
“不变”)。
②该反应的正反应为?(填“吸”或“放”)热反应。
(3)定条件下,将3 molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)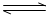 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___?_。 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___?_。
a.该条件下此反应的化学平衡常数表达式为
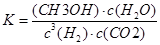
b.H2的平均反应速率为0.3mol/(L.s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
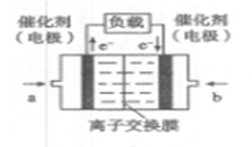
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是?(填“乙醇”或“氧气”),b处电极上发生的电极反应是:?。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其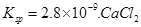 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为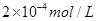 ,则生成沉淀所需CaCl2溶液的最小浓度为?。 ,则生成沉淀所需CaCl2溶液的最小浓度为?。
参考答案: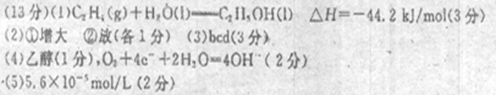
本题解析:
⑴2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g)?△H=十1411.0kJ/mol①
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol②
①-②得
C2H4(g)+H2O(l)=C2H5OH(l)?△H=―44.2kJ/mol
⑵由表中看出,温度一定时,提高氢碳比[著轰击],CO2的转化率①增大;氢碳比一定,提高温度,CO2的转化率,平衡逆向移动,正确反应②放热;
⑶bcd
3H2(g)+CO2(g) CH3OH(g)+H2O(g)。 CH3OH(g)+H2O(g)。
c始? 1.5? 0.5
c变? 0.6? 0.2? 0.2? 0.2
c平? 0.9? 0.3? 0.2? 0.2
a.正确;
b.不正确, H2的平均反应速率为0.3mol/(L.min)
c.不正确,CO2的转化率为0.2/0.5×100%=40%
d.不正确,混合气体的密度始终不变;
⑷a是电池的负极,原料是乙醇,O2+4e-+2H2O=4OH―
⑸2×2.8×10―9/1×10―4=5.6×10―5mol/L
本题难度:一般
|  CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数??(结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数??(结果保留小数点后两位数字)。
 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___?_。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___?_。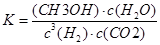

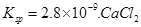 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为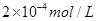 ,则生成沉淀所需CaCl2溶液的最小浓度为?。
,则生成沉淀所需CaCl2溶液的最小浓度为?。