| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《反应速率与平衡的有关计算》高频试题巩固(2017年最新版)(七)
(4)CH4和H2O在催化剂表面发生反应CH4+H2O  CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数??(结果保留小数点后两位数字)。 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数??(结果保留小数点后两位数字)。(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:  ①B极的电极反应式为?。 ②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole-时,实际上消耗的甲醇的质量比理论上大,可能原因是?。 (6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀??(填“能”或“否”)。 3、填空题 N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在恒容密闭容器中N2O5可发生下列反应: 2N2O5(g) ≒ 4NO2(g) + O2(g).△H﹥0
(3)在T2温度下,反应1000 s时测得NO2的浓度为4.98mol·L-1。则T2 __________ T1。(填“大于”“等于”或“小于”) 4、填空题 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示__________?, 5、填空题 CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。
①温度一定时,提高氢碳比[著轰击],CO2的转化率?(填“增大”“减小” “不变”)。 ②该反应的正反应为?(填“吸”或“放”)热反应。 (3)定条件下,将3 molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g) 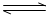 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___?_。 CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___?_。a.该条件下此反应的化学平衡常数表达式为 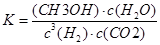 b.H2的平均反应速率为0.3mol/(L.s) c.CO2的转化率为60% d.若混合气体的密度不再改变时,该反应一定达到平衡状态 (4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是?(填“乙醇”或“氧气”),b处电极上发生的电极反应是:?。 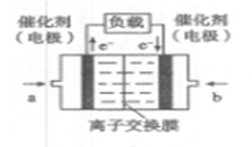 (5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 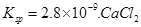 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为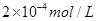 ,则生成沉淀所需CaCl2溶液的最小浓度为?。 ,则生成沉淀所需CaCl2溶液的最小浓度为?。 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《电解质溶液.. | |