1、填空题 (18分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:
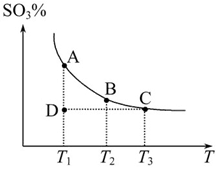
2SO2(g)+O2(g)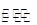 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g)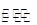 2SO3(g)的正反应为?反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
2SO3(g)的正反应为?反应(填“放热”、“吸热”);若在恒温、恒容条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”、“向右”或“不”);
②若温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1_______K2;若反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
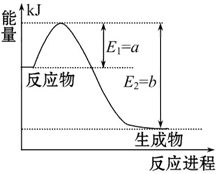
右图是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:______________。(ΔH的数值用含字母a、b的代数式表示)
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25 ℃下, 2.0×10-3 mol·L-1的NaCl溶液中逐滴加入适量的2.0×10-4? mol·L-1硝酸银溶液,?白色沉淀生成(填“有”、“没有”)。通过计算解释原因______________________________,向反应后的浊液中,继续加入2.0×10-3mol·L-1的NaI溶液,看到的现象是_____________________________,产生该现象的原因是_____________(用离子方程式表示)。(已知25 ℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16)
参考答案:(1)①放热(2分)?不(2分)
②> (2分)? >(2分)
(2)N2(g)+3H2(g)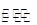 2NH3(g)?ΔH ="2(a-b)" kJ·mol-1(3分)
2NH3(g)?ΔH ="2(a-b)" kJ·mol-1(3分)
(3)有(1分)Q=c(Cl?)?c(Ag+)=1.0×10-3 ×1.0×10-4 =1.0×10-7 > Ksp,所以有沉淀生成(2分)
白色沉淀转化为黄色沉淀(2分)AgCl(s)+I-(aq)= AgI(s)+Cl-(aq)(2分)
本题解析:(1)①由图可知,温度越高,三氧化硫的含量越低,平衡向左移动,正反应放热;恒温、恒容条件下充入氦气,体积增不变,正逆反应速率不变,所以平衡不移动。
②温度越高,平衡越向左移动,平衡常数越小,故 K1>K2。状态D未达到平衡状态,要达到平衡状态,三氧化硫的含量要增大,即平衡需要向右移动,故v(正)>v(逆)。
(2)由图像可知N2和H2反应生成1 mol NH3的反应热为-(b-a) kJ·mol-1,可得热化学方程式为:N2(g)+3H2(g)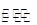 2NH3(g)? ΔH ="2(a-b)" kJ·mol-1
2NH3(g)? ΔH ="2(a-b)" kJ·mol-1
(3)通过计算比较浓度熵与Ksp的大小,Q=c(Cl?)?c(Ag+)=1.0×10-3 ×1.0×10-4 =1.0×10-7 > Ksp,所以有沉淀生成;沉淀向溶度积更小的方向转化,Ksp(AgCl)>Ksp(AgI),所以AgCl沉淀转化为更难溶的AgI,所以实验现象为白色沉淀转化为黄色沉淀;离子方程式为:AgCl(s)+I-(aq)= AgI(s)+Cl-(aq)。
本题难度:一般
2、选择题 在一密闭容器中,反应aA(g) bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
A.平衡向逆反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.化学计量数关系:a>b
参考答案:C
本题解析:在一密闭容器中,反应aA(g) bB(g),达到平衡后,保持温度不变,将容器体积增加1倍的瞬间,B的浓度是原来的50%。但当达到新的平衡时,B的浓度是原来的70%,这说明增大容器容积,压强降低平衡向生成B的方向移动,即向正反应方向移动,因此正方应是体积增大的,所以a<b,所以A、D不正确;A物质的转化率增大,B不正确;物质B的质量分数增加,C正确,答案选C。
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍的瞬间,B的浓度是原来的50%。但当达到新的平衡时,B的浓度是原来的70%,这说明增大容器容积,压强降低平衡向生成B的方向移动,即向正反应方向移动,因此正方应是体积增大的,所以a<b,所以A、D不正确;A物质的转化率增大,B不正确;物质B的质量分数增加,C正确,答案选C。
本题难度:一般
3、选择题 已知CO和H2在一定条件下合成甲醇的反应为CO(g)+2H2(g)  CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是(?)
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是(?)
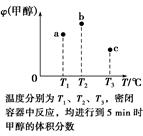
A.正反应的ΔH>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可将b中的平衡状态转变成c中的平衡状态
D.达到平衡时,a、b、c中CO的转化率为b>a>c
参考答案:C
本题解析:本题的关键点是温度不同,选取的时间是5 min,a肯定没有达到平衡,b可能达到平衡也可能没有,c肯定达到平衡。若三者均达到平衡,则甲醇的含量应依次降低,正反应是放热反应,A、B、D错误。
本题难度:一般
4、选择题 升高温度,下列数据不一定增大的是
A.化学反应速率v
B.水的离子积常数Kw
C.化学平衡常数K
D.弱电解质的电离平衡常数Ka
参考答案:C
本题解析:略
本题难度:一般
5、选择题 反应:A + 3B 2C + D,在四种不同情况下的反应速率分别为:
2C + D,在四种不同情况下的反应速率分别为:
① ②
②
③ ④
④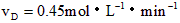
该反应进行得最快的是
[? ]
A.①
B.④
C.①④
D.②③
参考答案:B
本题解析:
本题难度:简单