1、填空题 (14分)钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
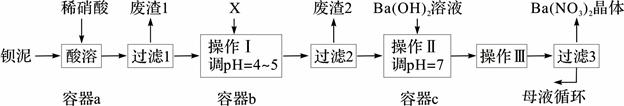
已知:i Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(4)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
参考答案:(1)BaSO4(s)+CO32-(aq) 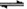 BaCO3(s)+SO42-(aq)(不写(s)、(aq)不扣分)增大碳酸根离子的浓度,使平衡正向移动从而除去BaSO4杂质(3分);
BaCO3(s)+SO42-(aq)(不写(s)、(aq)不扣分)增大碳酸根离子的浓度,使平衡正向移动从而除去BaSO4杂质(3分);
(2)Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O (2分);
(3)③(2分);Fe(OH)3(2分);(4)c(2分);(5) ×100%(3分)
×100%(3分)
本题解析:(1)在溶液中存在平衡:BaSO4(s)+CO32-(aq) 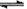 BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
(2)Ba(FeO2)2与HNO3反应生成两种硝酸盐,则根据原子守恒两种硝酸盐应该是硝酸铁和硝酸钡,同时还有水生成,反应的化学方程式为Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X是调节溶液pH,以沉淀溶液中的铁离子,由于不能引入杂质,实验根据本长的实际应该选择碳酸钡,答案选③;氢氧化铁在pH=3.2时就已经完全沉淀,则滤渣2的主要成分是Fe(OH)3(2分);(4)过滤3后的母液中含有氢氧化钡,因此应循环到容器c中;
(5)mg沉淀应该是硫酸钡,则碳酸钡的质量是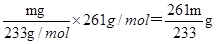 ,所以其纯度为
,所以其纯度为 ×100%。
×100%。
考点:考查物质制备工艺流程图的分析与应用
本题难度:困难
2、填空题 铬污染主要产生于铬矿的开采和冶炼。工厂排出的铬渣成分为SiO2、 A12O3、MgO、 Fe2O3、Na2Cr2O7等,其中危害最大的化学成分是Na2Cr2O7。已知:① Na2Cr2O7易溶于水,是强氧化剂。② +6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。下面是实验室模拟处理铬渣、消除铬污染的工艺流程如下(部分操作和条件略):
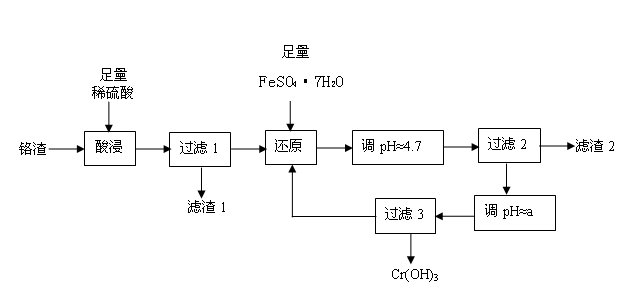
(1)在酸浸过程中,稀H2SO4溶解A12O3的离子方程式是 。
(2)过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+ H2O  2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
(3)用FeSO4·7H2O还原 Na2Cr2O7的离子方程式是 。
(4)已知:生成氢氧化物沉淀的pH
物质
| Fe(OH)3
| Al(OH)3
| Cr(OH)3
| Fe(OH)2
| Mg(OH)2
|
开始沉淀
| 1.5
| 3.4
| 4.9
| 6.3
| 9.6
|
完全沉淀
| 2.8
| 4.7
| 5.5
| 8.3
| 12.4
|
根据表中数据,流程中的a为 。
(5)分离滤渣2中物质,发生反应的离子方程式是 。
(6)过滤3所得滤液又回流到过滤1所得滤液中,其目的是 。
参考答案:(1)A12O3+6H+=2Al3++3H2O(1分)
(2)橙色 (1分)
(3)6Fe2++ Cr2O72-+14H+="6" Fe3++2 Cr3++7H2O (2分)
(4)5.5<=a<6.3 (1分)
(5)Al(OH)3+OH-=Al02-+2H2O; (2分 )
(6)目的是使还原剂FeSO4循环使用。 (1分 )
本题解析:(1)稀H2SO4溶解A12O3的离子方程式是:A12O3+6H+=2Al3++3H2O
(2)滤液中H+浓度增大平衡逆向移动,所以溶液呈橙色;
(3)FeSO4·7H2O被 Na2Cr2O7氧化成硫酸铁,离子方程式是6Fe2++ Cr2O72-+14H+="6" Fe3++2 Cr3++7H2O
(4)调节pH为4.7时已将Al3+、Fe3+全部沉淀,所以过滤之后再调pH应使Cr3+沉淀完全,但不能使残留的Fe2+沉淀,因此a的范围是5.5<=a<6.3
(5)滤渣2的成分是氢氧化铁与氢氧化铝,用氢氧化钠溶液分离,发生的离子方程式为Al(OH)3+OH-=Al02-+2H2O;
(6)过滤3所得滤液成分主要是硫酸亚铁,又回流到过滤1所得滤液中,其目的是使还原剂FeSO4循环使用。
考点:考查化学与工业的联系,离子方程式的书写,平衡的移动,分析问题的能力
本题难度:困难
3、选择题 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
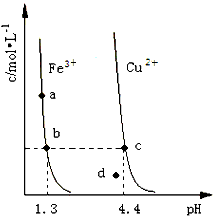
[? ]
A. 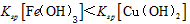
B. 加适量NH4Cl固体可使溶液由点变到点
C. 两点代表的溶液中与乘积相等
D. Fe(OH)3、Cu(OH)2分别在、两点代表的溶液中达到饱和
参考答案:B
本题解析:
本题难度:一般
4、选择题 25℃时,向AgCl的白色悬浊液中依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。已知有关物质的颜色和溶度积如下表:
物质
| AgCl
| AgI
| Ag2S
|
颜色
| 白
| 黄
| 黑
|
Ksp(25℃)
| 1.8×10-10
| 1.5×10-16
| 1.8×10-50
|
下列叙述中不正确的是
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,AgC1固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D.25℃时,AgC1固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的c(Ag+)相同
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (12分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式______________。
(2)根据等电子原理,写出CO分子的结构式________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,若Na2CO3溶液的浓度为2×10—4mo1/L,现将等体积的CaCl2溶液与Na2CO3溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______mo1/ L。
(4)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子的空间构型是_____,中心碳原子的轨道杂化类型为_____。1 mol甲醛分子中σ键的数目为________。
②甲醇可制作燃料电池,以KOH溶液作电解质,向两极分别充入甲醇和空气,工作过程中,负极反应方程式为:___________________。
③已知在常温常压下:
CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ? △H=" -556.0" kJ·mol-1
H2O(g)=H2O(l)? △H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
参考答案:(1)1s22s22p63s23p63d104s2
(2)C≡O (3)5.6×10—5
(4)①甲醇分子之间形成氢键,平面三角形,sp2杂化,1.806×1024
②CH3OH-6e-+8OH-=CO32-+6H2O ③CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l)△H=-725.8kJ/mol
本题解析:(1)Zn的原子序数为30,关键是要注意3d轨道写在4s轨道的前面,电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:N≡N,互为等电子体分子的结构相似,可写出CO的结构式为C≡O,故答案为:C≡O;
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1/2×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)×c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
(4)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸
点高;甲醛为sp2杂化,不含孤电子对,分子的空间构型为平面三角形;1mol甲醛分子中含有2mol碳
氢δ键,1mol碳氧δ键,故含有δ键的物质的量为3mol,数目为1.806×1024个;②正极得到电子,
发生还原反应,同时因为在碱性条件下,则OH-参与反应,根据总方程式可知产物是CO32-和6H2O所以答案为:CH3OH-6e-+8OH-=CO32-+6H2O③根据盖斯定律得 :热方程式1+热化学方程式2×1/2+热化学方程式3×2 则答案为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol
考点:考查共价键类型和热化学方程式书写等相关知识点
本题难度:困难