| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《气体的净化、干燥、吸收与收集》高频考点强化练习(2017年最新版)(十)
(3)写出上述装置A处的试管中所发生反应的化学方程式: ??。 Ⅱ、甲同学利用下图所示装置探究SO2和Cl2两种气体按不同比例混合后的漂白性。 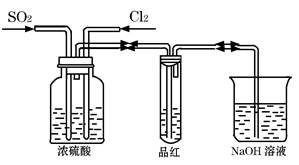 试分析: ①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: ?。 ②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ?(结合反应方程式)。 参考答案:Ⅰ、(1)a、c ;? b?(2)C E?(3)2NH4Cl+Ca(OH)2 本题解析:(1)装置A处应该制取氨气,A处的试管中所放药品的最佳选择为NH4Cl、Ca(OH)2,所以应该是a、c,装置D处制取二氧化碳,所选固体为碳酸钙,应选b。 本题难度:一般 3、选择题 下列除去杂质的方法正确的是?(?)
|
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《燃料和能源.. | |