1、计算题 (5分)实验室用8.7g的MnO2与足量的浓盐酸制取氯气:求生成氯气的体积(标准状况)和被氧化的HCl的物质的量。
2、实验题 (12分)硫酸亚铁铵(NH4)2SO4?FeSO4?6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下:
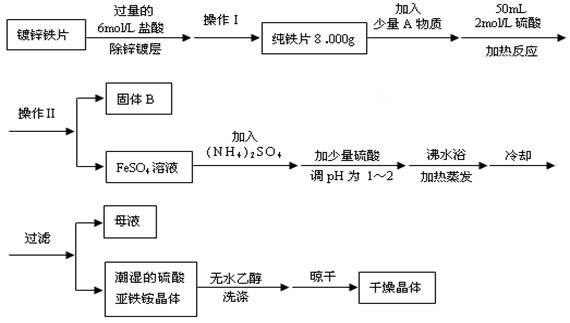
请回答下列问题:
(1)确定锌镀层被除去的标志是?;
计算上述铁片锌镀层的厚度,不需要的数据是?(填编号)。
a.锌的密度ρ(g/cm3)? b.镀锌铁片质量m 1(g)? c.纯铁片质量m 2(g)
d.镀锌铁片面积S(cm2)? e.镀锌铁片厚度h(cm)
(2)上述流程中:操作Ⅰ是取出铁片、?、?、称量。
(3)A物质可以为?(填编号)。
a.CuCl2? b.CuO? c.Cu(NO3)2? d.CuSO4?
(4)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是?。
(5)鉴定所得晶体中含有Fe2+、NH4+、SO42-离子的实验方法正确的是?(填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
3、实验题 (12分)实验室可利用乙醇、铜或铜的化合物制备乙醛,如图是某兴趣小组设计的实验装置,右侧的反应装置相同,而左侧的气体发生装置不同,试管C中装有水(加热装置未画出),试回答:
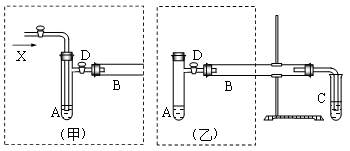
(1)?两套装置中的A、B处都需加热,A处用水浴加热,B处用__________加热,A处用水浴加热的主要优点是__________。
(2)?若按甲装置进行实验,B管处装铜粉,则通入A管的X是__________,B中反应的化学方程式是__________。
(3)?若按乙装置进行实验,则B管中应装__________,B中反应的化学方程式是__________。
(4)?实验结束后,取C试管中的溶液滴入新制备的银氨溶液并采用水浴加热可观察到有银镜生成,写出该过程的离子方程式__________ 。
(5)?实验完成后,应在C试管中加入__________可洗去银镜。
4、填空题 
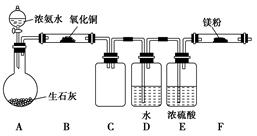
 (9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。
(9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。


(1)下面是化学课外小组的同学提出的实验室制备氨气的几种方案:
A.硫酸铵固体与消石灰共热
B.浓氨水逐滴加到新制的生石灰中
C.在一定条件下,氮气与氢气化合
D.加热分解氯化铵固体