1、选择题 将标准状况下的2.24 L CO2通入150 mL 1mol / LNaOH溶液中,下列说法正确的是
A.c(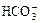 )略大于c(
)略大于c( )
)
B.该溶液只能与酸反应,不能与碱反应
C.c(Na+)等于c( )与c(
)与c(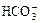 )之和
)之和
D.c(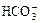 )略小于c(
)略小于c( )
)
参考答案:A
本题解析:略
本题难度:一般
2、选择题 己知0.1mol/LNaHCO3溶液显碱性,将此溶液加水稀释后,下列说法正确的是(?)
A.稀释后,溶液中各离子浓度均变小。
B.原溶液中,C(Na+)= C(HCO3-) + C(H2CO3) = 0.1mol/L
C.稀释后,溶液中C(Na+)/ C(HCO3-)比值增大
D.原溶液加入少量NaOH溶液后,其碱性减弱。
参考答案:C
本题解析:略
本题难度:一般
3、选择题 在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是
A.氯化铝
B.碳酸氢镁
C.碳酸钠
D.高锰酸钾
参考答案:C
本题解析:氯化铝为强酸弱碱盐,水解生成了氢氧化铝,加热灼烧后为氧化铝,故A不能选;B中碳酸氢镁在加热灼烧后,生成了碳酸镁和水和二氧化碳,故B不能选,碳酸钠在在蒸发皿中加热蒸干并灼烧(低于400℃)。得到的还是碳酸钠,故C为本题的答案;高锰酸钾加热会分解为锰酸钾、二氧化锰和氧气,故D不能选。
点评:本题考查了盐类水解、物质的热稳定性,该考点是高考考查的重点和难点,本题难度不大,关键是熟悉各物质的相关性质。
本题难度:简单
4、选择题 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是
[? ]
A.加水
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液
参考答案:D
本题解析:
本题难度:一般
5、选择题 35℃时,在0.1mol·L-1的Na2S,NaHS两溶液中均存在的关系是(? ).
A? c(OH-)×c(H+)=1×10-14
B? c(Na+)=c(S2-)+c(HS-)+c(H2S)
C? c(OH-)=c(H+)+c(HS-)+2c(H2S)
D? c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
参考答案:D
本题解析:在溶液中,c(OH-)×c(H+)=kw 35℃时,c(OH-)×c(H+)>1×10-14 在0.1mol·L-1的Na2S溶液中
物料守恒:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
质子守恒:c(OH-)=c(H+)+c(HS-)+2c(H2S)
在0.1mol·L-1的NaHS溶液中
物料守恒:c(Na+)=c(S2-)+c(HS-)+c(H2S)
电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
质子守恒:c(OH-)+c(S2-)=c(H+)+c(H2S)
综上分析,选(D)项.
本题难度:简单