1、选择题 下列判断正确的是.
[? ]
A.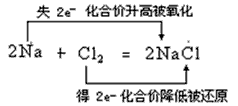
B.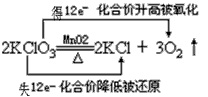
C.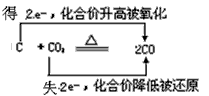
D.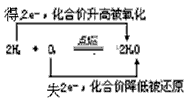
参考答案:A
本题解析:
本题难度:一般
2、计算题 将4.368 g铁粉完全溶于150 mL 2.0 mol·L-1的稀HCl中,然后通入0.009 mol Cl2,再加入2.94 g重铬酸钾晶体(K2Cr2O7)恰好使溶液中的Fe2+全部转化为Fe3+,重铬酸钾被还原为铬的低价阳离子,已知K2Cr2O7的相对分子质量为294,试求产物中铬元素的化合价。
参考答案:铬的化合价为+3
本题解析:设产物中铬的化合价为x,根据得失电子守恒有:
 ×1="0.009" mol×2+
×1="0.009" mol×2+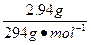 (6-x)×2,x=+3。
(6-x)×2,x=+3。
本题难度:简单
3、选择题 实验室常用NaNO2和NH4Cl反应制取N2。下列有关说法正确的是
[? ]
A.NaNO2是还原剂
B.NH4Cl中N元素被还原
C.生成1 mol N2时转移6 mol 电子
D.氧化剂和还原剂的物质的量之比是1︰1
参考答案:D
本题解析:
本题难度:简单
4、填空题 以下反应①②可用于从不同原料中提取碘:
①2NaI+MnO2+3H2SO4 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3 2Na2SO4+3NaHSO4+H2O+I2
2Na2SO4+3NaHSO4+H2O+I2
(1)反应①中的氧化剂是___________________;反应②中的还原产物是________________。
(2)根据反应①②可推知______。
a.氧化性:IO3->SO42-?b.氧化性:MnO2>NaIO3
c.还原性:I->Mn2+?d.还原性:I2>NaHSO3
(3)已知NaI和NaIO3在酸性条件下能反应生成I2 ,写出该反应的离子方程式:
③__________________________________________________________。
(4)三个反应中生成等量的I2时转移的电子数最少的是反应________(填序号)。
参考答案:(1)MnO2(二氧化锰);I2(碘)。
(2)a、c。
(3)5I-+5IO3-+6H+→3 I2+3H2O。
(4)③。
本题解析:(1)反应①中Mn元素化合价降低,则MnO2应为氧化剂,反应②中I元素的化合价降低,则I2为还原产物,故答案为:MnO2;I2;
(2)氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,反应①中氧化性:MnO2>I2,还原性:I->Mn2+,②中氧化性:IO3->SO42-,还原性:NaHSO3>I2,故答案为:a、c;
(3)NaI和NaIO3在酸性条件下能反应生成I2,反应的离子方程式为5I-+5IO3-+6H+=3I2+3H2O,故答案为:5I-+5IO3-+6H+=3I2+3H2O;
(4)反应①中生成1molI2转移电子2mol,反应②中生成1molI2转移电子10mol,反应中③生成1molI2转移电子5/3mol,则转移电子最小为③,故答案为:③.
本题难度:一般
5、选择题 下列反应属于非氧化还原反应的是
A.2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
B.2Mg+CO2 2MgO+C
2MgO+C
C.N2+3H2 2NH3
2NH3
D.SiO2+CaO CaSiO3
CaSiO3
参考答案:D
本题解析:非氧化还原反应即化合价没有发生变化的反应,前三项中均有单质参加或生成,化合价均有变化,是氧化还原反应,D项没有元素化合价发生变化,是非氧化还原反应。
点评:当元素处于最高价态时只有氧化性,最低价态时只有还原性,中间价态时既有氧化性又有还原性。属于简单题。
本题难度:简单