1、填空题 (8分)铜在常温下能被稀HNO3溶解:3Cu+8HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O
⑴ 请将上述反应改写成离子方程式:_____________________。
⑵ 上述反应中氧化剂是?,没有参加氧化还原反应的硝酸占总硝酸的比例_____。
(3)取1.92gCu与一定量浓HNO3恰好完全反应,生成气体颜色由红棕色逐渐变成无色,共得到标准状况下气体1.12L,则参加反应的硝酸为_____________mol。
参考答案:⑴ 3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O? ⑵? HNO3? 3/4?(3)0.11
本题解析:(1)考查离子方程式的书写。在改写离子方程式时,关键是找准哪些物质可以用离子符合来表示,哪些可以用化学式来表示。只有既能溶于水,又能完全电离的物质才能用离子来表示,其他的均用化学式表示。
(2)由方程式可知8mol硝酸参加反应其中只有2mol硝酸被还要,其氮元素的化合价由+5价降低到+2价,所以没有参加氧化还原反应的硝酸占总硝酸的比例3/4。
(3)生成气体颜色由红棕色逐渐变成无色,说明气体是NO和NO2的混合气体,其物质的量是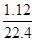 =0.05mol,根据氮元素守恒可知被还原的硝酸的物质的量就是0.05mol。1.92gCu被氧化生成Cu(NO3)2,其物质的量是
=0.05mol,根据氮元素守恒可知被还原的硝酸的物质的量就是0.05mol。1.92gCu被氧化生成Cu(NO3)2,其物质的量是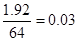 mol。同样根据氮元素守恒可知没有被还原的硝酸的物质的量就是0.03mol×2=0.06mol,参加反应的硝酸为0.06mol+0.05mol=0.11mol。
mol。同样根据氮元素守恒可知没有被还原的硝酸的物质的量就是0.03mol×2=0.06mol,参加反应的硝酸为0.06mol+0.05mol=0.11mol。
本题难度:一般
2、选择题 有下列反应:2KMnO4 + 5K2SO3 + 3H2SO4 ══ 6K2SO4 + 2MnSO4 + 3H2O ,在反应中还原产物和氧化产物的物质的量之比为
[? ]
A.1∶4
B.1∶3
C.2∶5
D.3∶2
参考答案:C
本题解析:
试题分析:
在反应:2KMnO4 + 5K2SO3 + 3H2SO4 ══ 6K2SO4 + 2MnSO4 + 3H2O 中,还原产物是指化合价降低得到的产物,是MnSO4 ;氧化产物是指化合价升高得到的产物,是K2SO4 。但6molK2SO4?中只有5mol是氧化产物,所以还原产物与氧化产物的物质的量之比为2:5。
故选:C
本题难度:简单
3、填空题 已知1 mol CuSCN在下列反应中失去7 mol电子,完成并配平下列化学反应方程式:CuSCN+KMnO4+H2SO4——HCN+CuSO4+MnSO4+K2SO4+H2O
参考答案:10CuSCN+14KMnO4+21H2SO4====10HCN+10CuSO4+14MnSO4+7K2SO4+16H2O
本题解析:观察反应前后Mn的化合价变化:
设CuSCN的化学计量数为x,KMnO4的化学计量数为y,根据得失电子的总数相等,则7x=5y,即x∶y=5∶7,代入后用观察法确定其他物质的化学计量数,最后使各项化学计量数变为整数,得:10、14、21、10、10、14、7、16。
本题难度:简单
4、选择题 对剧毒的氰化物可在碱性条件下用如下方法进行处理:
2CN- +8OH-+5Cl2= 2CO2 +N2 +10Cl- +4H2O 下列判断正确的是
A.当有0.2 mol CO2生成时,溶液中阴离子的物质的量增加1mol
B.该反应中,每有2molCN-反应,转移电子为10mol
C.上述反应中的还原剂是OH-
D.还原性:Cl-> CN-
参考答案:B
本题解析:氧化还原反应问题:正确判断反应中变价元素的化合价,理清氧化还原反应的基本概念和基本规律是解题的关键。A、由题给反应方程式知反应前后,阴离子的个数不变,所以当有0.2?mol?CO2生成时,阴离子的物质的量不变,错误;B、该反应中,CN-中的碳元素的化合价由+2价升高到+4价,氮元素的化合价由-3价升高到0价,1mol CN-参加反应转移5mol电子,每有2molCN-反应,转移电子为10mol,正确;C、该反应中,CN-中的碳元素的化合价由+2价升高到+4价,氮元素的化合价由-3价升高到0价,所以CN-是还原剂而不是OH-,错误;D、该反应中的还原剂是CN-,还原产物是Cl-,所以还原性CN->Cl-,错误。
本题难度:一般
5、选择题 下列各组物质由于浓度不同或用量不同而能发生不同氧化还原反应的是?(?)
①Cu与HNO3溶液;?②NaOH与A1Cl3溶液;
③Cu与H2SO4溶液;?④CH4与O2
A.①④
B.③④
C.①③④
D.①②③④
参考答案:A
本题解析:略
本题难度:简单