1、选择题 利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
(1)负极材料是________(写名称),电极反应为__________________。
(2)正极电极反应式为__________________________________。
(3)溶液中SO42—向________极移动。
参考答案:(1)铜 Cu-2e-=Cu2+ (2)O2+4e-+4H+=2H2O (3)负
本题解析:该氧化还原反应中还原剂为Cu,故负极是铜,电极反应为Cu-2e-=Cu2+,氧化剂是O2,故正极反应为O2+4e-+4H+=2H2O,溶液中阴离子SO42—向负极移动。
本题难度:一般
2、填空题 (8分)用锌棒、石墨和CuCl2溶液组成的原电池,锌棒为_?__极,电极反应式为________?_,石墨为_?__极,电极反应式为______,原电池反应的离子方程式为___________?。
参考答案:_负 _, ___Zn? -? 2e- =Zn2+_____, _?正 __ , ____Cu2+ +2e- =Cu__?_? _, _Zn +Cu2+ ="Cu" + Zn2+。
本题解析:略
本题难度:简单
3、填空题 化学反应伴随着能量变化是化学反应的基本特征之一。 请填写下列空白:
(1)从能量的角度看,断开化学键要___(填“吸收”或“放出”,下同)能量;所有的燃烧反应都要____热量。
(2)有甲、乙、丙三种金属片,
①把甲、乙用导线连接后同时浸入稀硫酸中,乙上有气泡产生;
②将乙、丙用导线连接后同时浸入稀硫酸中,电子的流动方向为乙→导线→丙。
则在①中,金属片____(填“甲”或“乙”)发生氧化反应;
三种金属的活动性由强到弱的顺序是____。
(3)铜与浓硝酸反应时有____色NO2气体产生;当有1 mol HNO3参加反应时, HNO3得到电子的物质的量为____ mol。
参考答案:(1)吸收; 放出
(2)甲 ;甲>乙>丙
(3)红棕; 0.5
本题解析:
本题难度:一般
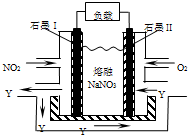
4、选择题 NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,该电池在使用过程中石墨I电极上生成氧化物Y,下列说法不正确的是( )
A.石墨I附近发生的反应为NO2+NO3--e-═N2O5
B.石墨Ⅱ附近反生的反应为O2-4e-═2O2-
C.该电池放电时NO3-从右侧向左侧迁移
D.相同条件下,放电过程中消耗的NO2和O2的体积比为4:1